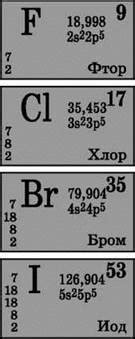Бром (Br) - интересное химическое вещество, которое вызывает много вопросов у ученых и исследователей. Основной вопрос, который они задают себе - является ли бром металлом или неметаллом? Ответ на этот вопрос не так уж и прост, так как бром находится на границе между этими двумя группами химических элементов.
Бром обладает некоторыми свойствами металлов, такими как проводимость электричества и тепла. Он также может образовывать ионы, что является характерной особенностью металлов. Однако, бром не имеет металлического блеска и не является твердым веществом при комнатной температуре, что противоречит концепции металлов.
С другой стороны, бром обладает некоторыми характеристиками неметаллов. Например, он образует ковалентные связи и обычно входит в соединения с другими неметаллами. Он также имеет низкую плотность и низкую температуру плавления, что характерно для неметаллов.
В итоге, можно сказать, что бром обладает свойствами и металлов, и неметаллов, что делает его уникальным химическим элементом. Это частично металл, частично неметалл. Такое положение находится на границе двух миров и привлекает внимание ученых, которые проводят дальнейшие исследования и анализы, чтобы полностью понять природу брома.
Бром: символ и свойства элемента
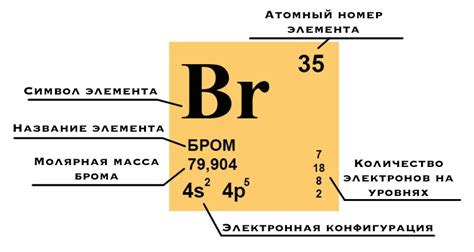
Бром (Br) – химический элемент, относящийся к группе галогенов, обозначается символом Br.
Бром является красновато-коричневым жидким веществом, имеющим неприятный запах. Он обладает высокой реактивностью и встречается в природе в виде минерала - бромистового руды. Бром активно взаимодействует с другими элементами и образует различные соединения.
Одно из основных свойств брома - его способность окрашивать органические соединения. Бром обладает окислительными свойствами, способен действовать на кожу и слизистые оболочки, поэтому при работе с ним необходимо соблюдать основные правила безопасности.
Бром широко используется в химической промышленности, в качестве реагента в различных химических процессах. Он также применяется в производстве фотосветопечати, в производстве лекарственных препаратов и водоочистке.
Распространение брома в природе

Бром является очень распространенным элементом в природе. Он образуется в различных геологических процессах и присутствует в различных средах – воздухе, водах, почве.
Большое количество брома содержится в морской воде – его концентрация здесь очень высока. Также бромом обогащены морские растения и животные, поскольку они принимают его из воды.
Бром присутствует и в пресноводных источниках, в том числе в озерах и реках. Его концентрация может быть ниже, но все равно достаточно высока для того, чтобы оказывать влияние на биологические системы, включая животных и растения.
Бром также может накапливаться в почве, особенно в болотистых и болотных районах. Он может быть связан с органическими и неорганическими частицами почвы и может оказывать эффект на качество почвенных систем.
Однако величина содержания брома в природных системах может быть очень варьирующей, в зависимости от региона и условий. Некоторые районы могут иметь более высокую концентрацию брома, в то время как другие могут быть более низкими.
Исследования распространения брома в природе не только помогают понять его влияние на окружающую среду и биологические системы, но и позволяют использовать его в различных сферах человеческой деятельности, например, в производстве химических веществ и лекарств.
Физические свойства брома

Температура плавления и кипения: Бром обладает относительно низкой температурой плавления (-7,2 °С) и кипения (58,8 °С), что делает его жидким при комнатной температуре и обычном атмосферном давлении. Это одна из причин, почему бром часто используется в жидких состояниях в различных приложениях, таких как фотография и огнетушители.
Цвет: Бром обладает ярко-красным цветом, который делает его легко узнаваемым. Это физическое свойство также обуславливает его применение в некоторых химических экспериментах, а также в ярких светопрочных красках.
Плотность: Плотность брома составляет около 3,12 г/см³. Это означает, что бром плотнее воды и может легко перемешиваться с ней при нормальных условиях. Также это свойство делает бром полезным в различных химических процессах, где необходимо создать различные слои или отделения веществ.
Растворимость: Бром растворяется в органических растворителях, таких как этанол и эфир, но плохо растворяется в воде. Это свойство делает бром полезным в процессах органического синтеза и анализа, а также позволяет использовать его в различных методах анализа и обнаружения определенных веществ.
Токсичность: Бром является токсичным веществом и может вызывать серьезные заболевания и повреждения органов при попадании на кожу, в глаза или при вдыхании его паров. Поэтому необходимо соблюдать особые меры предосторожности при работе с бромом и использовать соответствующие средства защиты.
Химические свойства брома

1. Реакция с металлами: Бром может реагировать с различными металлами, образуя бромиды. В зависимости от металла и условий реакции, образование бромида может сопровождаться выделением тепла или света.
2. Взаимодействие с кислородом: Бром может реагировать с кислородом, образуя оксид брома (Br2O). Этот оксид обычно является красной жидкостью и характеризуется резким запахом.
3. Реакция с неметаллами: Бром может реагировать с различными неметаллами, такими как сера, фосфор и йод, образуя соответствующие бромиды. Например, реакция брома с йодом приводит к образованию бромида йода (IBr).
4. Окислительные свойства: Бром имеет сильные окислительные свойства. Он может окислять некоторые вещества, например, окислять органические соединения или даже взаимодействовать с водородом, образуя воду и выделяя бромид в качестве продукта реакции.
5. Образование комплексных соединений: Бром может образовывать комплексные соединения с различными металлами. Комплексы брома имеют разнообразные свойства и применяются в различных областях химии и промышленности.
6. Реакция с органическими соединениями: Бром может взаимодействовать с органическими соединениями и образовывать различные продукты. Например, реакция брома с алкенами приводит к образованию алифатических бромидов, которые являются важными промежуточными продуктами в синтезе органических соединений.
7. Способность к взаимодействию с водой: Бром может реагировать с водой, образуя бромоводородную кислоту (HBr). Эта кислота обладает сильными кислотными свойствами и является важным химическим веществом, используемым в различных процессах.
8. Изменение окраски: Бром может изменять окраску различных веществ. Например, взаимодействие брома с крахмалом приводит к образованию синего комплекса, который используется в аналитической химии для определения присутствия брома в растворах.
Использование брома в промышленности

Бром является важным химическим элементом, который широко используется в различных отраслях промышленности.
Фотография:
В фотографии бром часто используется в качестве реагента для процессов обработки и обкладки фотопленки. Бромсодержащие соединения используются в процессе печати, чтобы обеспечить качественные и стойкие фотографии.
Огнезащитное покрытие:
Бромовые соединения используются в промышленности для создания огнезащитных покрытий. Бром обладает высокой эффективностью в уменьшении горючести материалов, поэтому применение бромсодержащих соединений позволяет повысить безопасность и предотвратить распространение огня.
Производство пластиков:
Бромовые соединения используются в процессе производства пластиков для придания им необходимых свойств, таких как устойчивость к огню и химическим воздействиям. Бромовые соединения также улучшают прочность и термостойкость пластиковых материалов.
Производство фармацевтических препаратов:
Бром используется в производстве некоторых фармацевтических препаратов, так как способен образовывать стабильные соединения с различными органическими веществами. Бром имеет противовоспалительное и антисептическое действие, поэтому его соединения используются в производстве лекарственных препаратов.
Производство хладагентов:
Бром использовался в прошлом в качестве хладагента, однако в настоящее время его применение снизилось из-за негативного влияния на окружающую среду. Однако некоторые бромсодержащие хладагенты все еще используются в специализированных технологических процессах.
Таким образом, бром имеет широкий спектр применения в промышленности, от фотографии и огнезащитных покрытий до производства пластиков, фармацевтических препаратов и хладагентов. Его уникальные свойства позволяют использовать этот химический элемент для создания различных продуктов и материалов, которые обладают необходимыми характеристиками.
Медицинское применение брома

Бром является важным элементом в медицине и используется для лечения различных заболеваний. Его применение связано с его способностью влиять на нервную систему и оказывать седативное действие.
Бром применяется в качестве седативного и успокоительного средства, которое помогает при бессоннице, неврозах, тревоге и других психических расстройствах. Он способен улучшить качество сна и снять нервное напряжение, что позволяет пациентам расслабиться и получить нормальный отдых.
Кроме того, бром используется в лечении эпилепсии. Он помогает снизить частоту и тяжесть эпилептических припадков, улучшает общее состояние пациента и уменьшает количество принимаемых противоэпилептических препаратов.
Также бром применяется в составе препаратов для лечения заболеваний щитовидной железы. Он способствует снижению образования и выделения гормонов щитовидной железы, что помогает в контроле гормонального баланса у пациентов с повышенной функцией щитовидной железы.
Важно отметить, что бром должен использоваться только по назначению врача, так как его неправильное применение может вызвать побочные эффекты и негативные последствия для здоровья. Всегда консультируйтесь с профессионалом перед началом лечения.
Бром в экологии и вредность для организмов
Бром является одним из основных загрязнителей окружающей среды и оказывает негативное воздействие на организмы.
Основным источником брома в окружающей среде является антропогенная деятельность, включая промышленность и сельское хозяйство. Бром попадает в атмосферу в результате выбросов из промышленных предприятий и сжигания отходов. Оттуда он оседает на землю и воду, загрязняя их. Бром также содержится в пестицидах и гербицидах, которые часто применяются в сельском хозяйстве.
Бром оказывает вредное воздействие на живые организмы. При попадании в организм бром может вызвать различные заболевания и отравления. Некоторые организмы могут накапливать бром в тканях, что приводит к нарушению их функций и метаболизма. Бром оказывает также негативное воздействие на растения, приводя к их замедленному росту и повреждению листьев и корней.
Кроме того, бром может приводить к образованию вредных соединений в окружающей среде. Например, в результате взаимодействия брома с органическим веществом при сжигании, образуются диоксины, которые являются мощными токсинами и имеют негативное воздействие на здоровье человека и животных.
Учитывая все вышеизложенное, необходимы меры по ограничению выбросов брома в окружающую среду и сокращению его использования в промышленности и сельском хозяйстве. Только таким образом можно снизить вредность брома и сохранить экологическое равновесие в природе.
Вопрос-ответ

Какие свойства брома относят его к группе неметаллов?
Бром является неметаллическим химическим элементом, так как он обладает свойствами, характерными для неметаллов. Он не имеет металлического блеска, не проводит ток электричества, является хрупким и не обладает хорошей теплопроводностью.
Какие свойства брома позволяют отнести его к металлам?
Бром является неметаллом, а не металлом. Однако, в некоторых случаях он может образовывать ионы с отрицательным зарядом, например, бромидные ионы (Br-). Это может привести к некоторому недопониманию и путанице, однако в общепринятой классификации бром относится к неметаллам.