Барий, являясь химическим элементом с атомным номером 56 и символом Ba в периодической системе химических элементов, относится к щелочноземельным металлам. В то время как щелочноземельные металлы в общем характеризуются высокой реактивностью с неметаллами, барий, в отличие от своих соседей по группе, обнаруживает плохую реактивность при взаимодействии с некоторыми неметаллами.
Одна из причин плохой реактивности бария с неметаллами щелочноземельных металлов заключается в его положении в периодической системе. Барий находится в начале периода и имеет более низкую электроотрицательность, чем остальные щелочноземельные металлы. Это означает, что барий не обладает такой сильной склонностью к принятию или передаче электронов, что делает его менее реактивным с некоторыми неметаллами.
Кроме того, размер атома бария также влияет на его реактивность. Атом бария имеет более крупный размер по сравнению с атомами других щелочноземельных металлов, что делает сложным проникновение его электронной оболочки в область, где находятся электроны неметаллов. Это также ограничивает возможность бария вступать в химические реакции с неметаллами.
Причины низкой активности бария с неметаллами

Барий, химический элемент из группы щелочноземельных металлов, обладает низкой активностью в реакциях с неметаллами. Это можно объяснить несколькими причинами.
- Положение бария в периодической системе. Барий находится ниже кальция и магния, которые обладают большей активностью в реакциях с неметаллами. Это связано с наличием большей энергии наружного электрона у кальция и магния, что облегчает образование химических связей с другими элементами.
- Поляризирующая сила бария. Поляризирующая сила элемента зависит от его заряда и размера. Барий обладает большим размером и меньшим зарядом, что ослабляет взаимодействие с неметаллами.
- Образование устойчивых соединений. Барий образует устойчивые соединения с неметаллами, которые трудно реагируют с другими веществами. Например, барий образует нерастворимый барийсульфат, который мешает дальнейшей реакции с неметаллами.
Таким образом, низкая активность бария с неметаллами обусловлена его положением в периодической системе, его поляризирующей силой и образованием устойчивых соединений. Эти факторы влияют на взаимодействие бария с неметаллами и определяют его реактивность.
Абсорбционные свойства бария

Барий, химический элемент из группы щелочноземельных металлов, обладает высокой абсорбционной способностью. Это означает, что он способен активно взаимодействовать с другими веществами и поглощать их.
Барий имеет большую абсорбционную способность к некоторым неметаллам, таким как кислород и сера. Он может образовывать стойкие соединения с этими элементами, что делает его полезным в различных отраслях промышленности. Например, в химической промышленности барий используется в качестве катализатора при производстве специальных химических соединений.
Барий также проявляет абсорбционные свойства в отношении радиоактивных элементов. Он может активно поглощать радиоактивные изотопы и образовывать стабильные соединения с ними. В медицине барий используется как контрастное вещество при рентгенологических исследованиях, так как он способен образовывать ярко окрашенные соединения.
Таким образом, абсорбционные свойства бария делают его важным элементом в разных областях применения, от промышленности до медицины. Его способность взаимодействовать с различными веществами открывает широкий спектр возможностей и делает его неотъемлемой частью современного мира.
Влияние электронной конфигурации на реакционную способность
Реакционная способность бария с неметаллами щелочноземельных металлов является важным аспектом изучения химической реактивности. Одним из факторов, влияющих на реакционную способность, является электронная конфигурация бария.
Электронная конфигурация бария состоит из 56 электронов, распределенных по энергетическим уровням и подуровням. Это связано с тем, что атом бария имеет 2 электрона в первой энергетической оболочке, 8 электронов во второй оболочке и 18 электронов в третьей оболочке. Оставшиеся 28 электронов заполняют уровень f. Наличие электронов внутреннего уровня f оказывает значительное влияние на реакционную способность бария.
Электроны во внутреннем уровне f создают сильное поглощение внешних электронов, что затрудняет их взаимодействие с неметаллами. Барий имеет высокую энергию ионизации, что делает его менее склонным к образованию ионов и реакции с неметаллами щелочноземельных металлов.
Таким образом, электронная конфигурация бария играет важную роль в определении его реакционной способности с неметаллами щелочноземельных металлов. Изучение этого явления позволяет лучше понять химические свойства и реакционную способность бария.
Реакция бария с неметаллами щелочноземельных металлов

Барий – химический элемент из группы щелочноземельных металлов, обладающий атомным номером 56 и химическим символом Ba. При контакте с неметаллами щелочноземельных металлов барий обычно проявляет низкую реактивность, хотя в некоторых случаях она может быть увеличена при определенных условиях.
Одним из наиболее известных примеров реакции бария с неметаллами щелочноземельных металлов является реакция с кислородом. При нагревании бариевого порошка с кислородом происходит образование оксида бария (BaO). Этот процесс является экзотермическим и сопровождается выделением значительного количества тепла.
Другим примером реакции бария с неметаллами щелочноземельных металлов является его реакция с серой. При смешивании бариевого порошка с порошком серы и последующем нагревании до высокой температуры происходит образование сернистого бария (BaS). В данной реакции барий проявляет свою химическую активность и связывается с серой, образуя химическое соединение.
Также барий может реагировать с другими неметаллами, такими как фосфор, азот или германий. Однако реактивность бария в этих случаях обычно невысока и требует специальных условий для ее проявления.
Отсутствие способности бария образовывать стабильные соединения с неметаллами
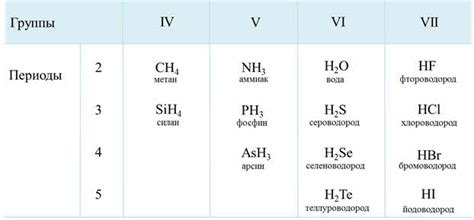
Барий, химический элемент с атомным номером 56, представителем щелочноземельных металлов, обладает низкой реактивностью при контакте с неметаллами. Один из наиболее ярких примеров отсутствия способности бария образовывать стабильные соединения с неметаллами - его реакция со свободным воздухом.
При взаимодействии бария с кислородом, содержащимся в воздухе, образуются оксиды, такие как двуокись бария. Однако это соединение является нестабильным и легко разлагается обратно на барий и кислород при нагревании или при воздействии влаги. Таким образом, происходящая реакция слабая и не позволяет барию формировать устойчивые оксиды, отличающиеся стабильностью и устойчивостью к внешним воздействиям.
Также, барий проявляет низкую реактивность при взаимодействии с другими неметаллами, такими как сера и фосфор. Взаимодействие бария с серой приводит к образованию сероводорода, который является химически активным и не образует стойких соединений с барием. Аналогично, реакция бария с фосфором дает фосфид бария, однако этот соединение также является нестабильным и не обладает высокой устойчивостью.
Таким образом, взаимодействие бария с неметаллами щелочноземельных металлов не приводит к образованию стабильных соединений. Это обусловлено низкой реактивностью бария и его неспособностью образовывать химически стойкие связи с неметаллами. В связи с этим барий обычно применяется в качестве легировующего элемента или в других процессах, где его низкая реактивность является преимуществом.
Реакции бария с неметаллами в условиях высоких температур
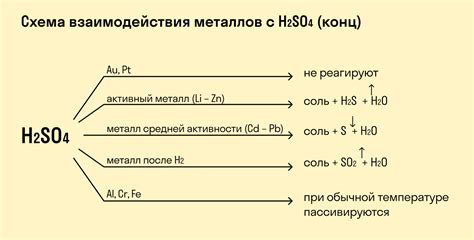
Барий, щелочноземельный металл, проявляет низкую реактивность с неметаллами в обычных условиях, однако при повышенных температурах может происходить его взаимодействие с некоторыми элементами.
Высокая температура позволяет преодолеть энергетический барьер, что способствует активации реакции бария с неметаллами. Одним из примеров таких реакций является реакция бария с кислородом при нагревании. В результате образуется оксид бария (BaO), который является слабосолюбельным в воде и используется в производстве стекла, керамики и других материалов.
В условиях высокой температуры также может происходить взаимодействие бария с серой, приводящее к образованию сульфида бария (BaS). Этот соединение имеет низкую температуру плавления и используется в качестве сырья для производства смазок, резиновой промышленности и других отраслей.
Реакция бария с азотом может также протекать при повышенных температурах и приводить к образованию нитрида бария (Ba3N2). Это соединение используется как катализатор в промышленности и в качестве источника азота при производстве удобрений.
Таким образом, реакции бария с неметаллами в условиях высоких температур имеют практическое значение и позволяют получать различные соединения, используемые в различных отраслях промышленности.
Вопрос-ответ

Почему барий реагирует плохо с неметаллами щелочноземельных металлов?
Барий, как и другие щелочноземельные металлы, обладает высокой реактивностью благодаря своей внешней электронной конфигурации, состоящей из двух электронов в s-орбиталях. Такие металлы обычно легко отдают эти электроны, образуя положительные ионы. Однако, барий является исключением из данного правила. Это связано с тем, что барий имеет металлическую структуру и его электроны слабо связаны с ядром. Поэтому барий не проявляет высокой реактивности при контакте с неметаллами щелочноземельных металлов.
Можно ли использовать барий в реакциях с неметаллами щелочноземельных металлов?
Хотя барий обычно проявляет плохую реактивность при контакте с неметаллами щелочноземельных металлов, его все равно можно использовать в определенных условиях. Например, при высоких температурах и давлениях барий может образовывать сплавы или соединения с неметаллами щелочноземельных металлов. Также, добавление определенных катализаторов или использование специальных реакционных условий может способствовать активации реакции между барием и неметаллами щелочноземельных металлов.
