Азотная кислота (HNO3) является сильным окислителем и обладает высокой коррозионной активностью. Взаимодействие азотной кислоты с металлами часто приводит к образованию солей и выделению водорода. Это происходит благодаря способности HNO3 окислять металлы и превращать их в соответствующие ионы.
В процессе окисления металлов азотной кислотой выделяется водородный газ. Это связано с тем, что азотная кислота действует как источник кислорода, который окисляет металлы, освобождая атомы водорода. При этом азотная кислота сама восстанавливается и превращается в азотокислоту.
Выделение водорода при взаимодействии азотной кислоты с металлами может происходить как при комнатной температуре, так и при нагревании. При этом скорость и интенсивность выделения водорода зависят от концентрации азотной кислоты, температуры, свойств металла и особенностей его поверхности. Выделение водорода при взаимодействии азотной кислоты с металлами является важным процессом в промышленности, используемым, например, для получения водорода или для очистки металлических поверхностей от окислов и загрязнений.
Взаимодействие азотной кислоты с металлами

Азотная кислота (HNO3) является одной из наиболее распространенных кислот в химической промышленности. Она обладает сильными окислительными свойствами и способна реагировать с различными веществами, включая металлы.
Взаимодействие азотной кислоты с металлами приводит к образованию соответствующих солей и выделению водорода. Этот процесс называется обменной реакцией. Обычно, при взаимодействии азотной кислоты с металлом, происходит окисление последнего, азотная кислота при этом выступает окислителем.
Реакция взаимодействия азотной кислоты с металлом протекает следующим образом: азотная кислота диссоциирует на ионы H+ и NO3- , после чего ионы NO3- реагируют с металлической поверхностью. При этом выделяется молекулярный водород (H2), а в раствор остаются ионы металла и ионы NO3- , образуя нитрат металла.
Взаимодействие азотной кислоты с металлами может быть реактивным и опасным, поскольку процесс выделения водорода сопровождается высвобождением большого количества энергии и образованием пузырей газа. Поэтому необходимо быть осторожным при проведении таких опытов и соблюдать меры безопасности.
Однако, в некоторых случаях взаимодействие азотной кислоты с металлами может быть использовано в промышленности, например, для получения водорода или производства нитратов. Механизм данных реакций требует детального изучения и понимания, чтобы оптимизировать эти процессы и достичь наибольшей эффективности.
Понятие азотной кислоты

Азотная кислота (HNO3) - это одна из наиболее распространенных и хорошо изученных неорганических кислот. Ее образуют путем смешивания пентоксида азота (N2O5) с водой. Азотная кислота является жидкостью без цвета или слегка желтоватого оттенка, обладает резким запахом и является сильным окислителем.
Азотная кислота обладает значительной реакционной способностью, проникает в большинство органических и неорганических соединений. Она может взаимодействовать с металлами, образуя соответствующие нитраты и выделяя водород. Этот процесс широко используется в лабораторной практике для выделения и измерения объема выделившегося водорода.
Азотная кислота также является важным компонентом в производстве удобрений и взрывчатых веществ. Ее нитраты используются в аграрной и пищевой промышленности, а также в производстве пластмасс и промышленной химии.
Химические свойства азотной кислоты
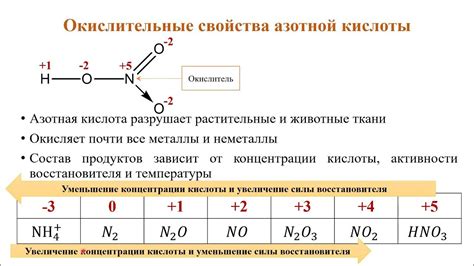
Азотная кислота (HNO3) является одним из наиболее распространенных и активных оксидаторов. Она обладает рядом химических свойств, которые делают ее важным и опасным веществом.
Азотная кислота является сильной кислотой и образует ионы H+ и NO3-. Она растворяется в воде и полностью диссоциирует. Эта кислотность делает азотную кислоту опасной для обработки, поскольку она может вызывать ожоги кожи и слизистых оболочек.
Азотная кислота проявляет окислительные свойства. Она способна окислять некоторые вещества, отдавая кислород или получая электроны, а также уменьшая свою степень окисления в процессе. Это свойство делает ее полезной в различных промышленных и лабораторных процессах, в которых требуется окисление веществ.
Азотная кислота также реагирует с металлами, образуя соли нитратов. При этом наблюдается образование водорода. Этот процесс является одним из важных способов выделения водорода. Нитраты, полученные в результате реакции азотной кислоты с металлами, являются важными сельскохозяйственными удобрениями.
Таким образом, азотная кислота обладает рядом химических свойств, которые делают ее полезной и опасной веществом. Она является сильной кислотой, обладает окислительной активностью и способна взаимодействовать с металлами, образуя соли нитратов и выделяя водород.
Металлы и их реакции с азотной кислотой

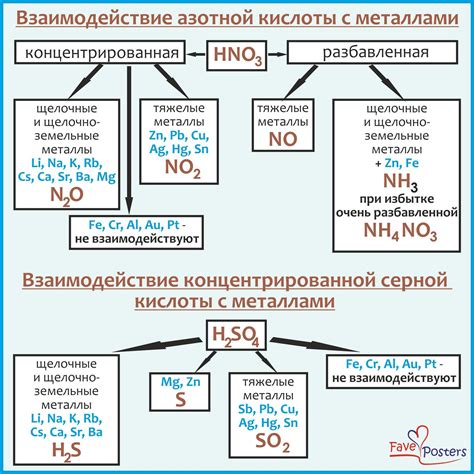
Металлы могут проявлять различные реакции при взаимодействии с азотной кислотой. Азотная кислота является сильным окислителем, поэтому реакции с металлами обычно проявляются в виде окисления металла и выделения водорода.
Некоторые металлы, такие как цинк и алюминий, реагируют с азотной кислотой с образованием азотных солей и выделением водорода. Эти реакции могут быть достаточно интенсивными и сопровождаются появлением пузырьков газа и шипением.
Другие металлы, например железо или свинец, могут реагировать с азотной кислотой, но реакция происходит медленно и без явного выделения водорода. В результате образуются соответствующие соли металлов и оксид азота.
Реакция металлов с азотной кислотой может наблюдаться и в более сложных системах, например в присутствии металлических сплавов или порошков. В таких случаях процесс окисления может происходить более интенсивно или быть сопровожден образованием разнообразных соединений металла с азотом.
Выделение водорода при взаимодействии азотной кислоты с металлами
Азотная кислота представляет собой сильный окислитель, способный взаимодействовать с различными металлами. Одним из результатов этого взаимодействия является выделение водорода.
При контакте азотной кислоты с металлом, происходит реакция, при которой ион водорода освобождается и образуется азота. Особенностью этого процесса является то, что выделяющийся водород является газообразным и особо легким, что делает его очень важным и опасным веществом.
Для обеспечения безопасности при проведении экспериментов с выделением водорода необходимо соблюдать определенные меры предосторожности. Необходимо работать только в хорошо проветриваемом помещении, избегая скопления взрывоопасных паров. Также следует следить за открытым огнем и источниками искр, так как водород является очень воспламеняемым веществом.
Однако, помимо опасностей, выделение водорода при взаимодействии азотной кислоты с металлами находит широкое применение в различных областях. Например, полученный водород может использоваться в качестве горючего, энергетического ресурса или при производстве водородных соединений.
Отметим, что взаимодействие азотной кислоты с металлом можно проводить только при соблюдении специальных условий и контроля над реакцией. Неправильное обращение с этими веществами может привести к серьезным последствиям. Поэтому, в работе с азотной кислотой и металлами необходимо быть внимательным и ответственным.
Практическое применение процесса
Реакция взаимодействия азотной кислоты с металлами, сопровождающаяся выделением водорода, имеет широкое практическое применение в различных областях науки и промышленности.
В промышленности процесс выделения водорода из азотной кислоты может быть использован для производства водорода в крупномасштабном производстве. Полученный водород может быть затем использован в различных отраслях промышленности, таких как производство кислорода и аммиака, водородное топливо или в процессах жидкостного водородного хранения.
В лаборатории этот процесс может быть использован для получения водорода для проведения различных химических экспериментов. Выделенный водород может быть использован в качестве редуктирующего агента или в качестве источника водорода для непосредственного использования в других химических реакциях.
Также, процесс выделения водорода из азотной кислоты может быть применен в процессах подводной сварки, где водород используется в качестве защитного газа для предотвращения окисления металлической поверхности при сварке под водой.
Дополнительно, получаемый водород может быть использован в процессах чистки и уборки, так как он является очень эффективным агентом дезинфекции и отбеливания. Кроме того, выделенный водород может быть использован в ракетостроении и аэрокосмической промышленности в качестве ракетного топлива для реактивных двигателей.
Влияние условий на выделение водорода
Выделение водорода при взаимодействии азотной кислоты с металлами может происходить под различными условиями, которые существенно влияют на процесс и его эффективность. Одним из ключевых факторов, определяющих выделение водорода, является концентрация азотной кислоты и металла в реакционной смеси. Высокая концентрация азотной кислоты может способствовать более интенсивному выделению водорода, однако может также вызвать нежелательные побочные реакции и повышенную опасность.
Температура также влияет на выделение водорода при реакции азотной кислоты с металлами. Повышение температуры обычно ускоряет процесс выделения водорода, так как увеличивается скорость химических реакций. Однако слишком высокая температура может привести к нежелательным побочным эффектам, например, испарению или деструкции составляющих реакционной смеси веществ.
Еще одним фактором, влияющим на выделение водорода, является наличие катализаторов. Некоторые металлы, такие как платина, медь или никель, способны значительно ускорить реакцию и увеличить выход водорода. Катализаторы обычно применяются в небольших количествах и могут значительно повлиять на ход реакции.
Суммируя, условия, в которых происходит реакция выделения водорода при взаимодействии азотной кислоты с металлами, имеют существенное влияние на эффективность процесса. Концентрация, температура и наличие катализаторов определяют скорость реакции и выход водорода, поэтому их правильный выбор и контроль являются важными аспектами данного процесса.
Вопрос-ответ

Какое взаимодействие происходит между азотной кислотой и металлами?
Азотная кислота реагирует с металлами, образуя соли и выделяя водород. Это реакция окисления металла азотной кислотой.
Какой металл реагирует с азотной кислотой?
Многие металлы могут реагировать с азотной кислотой, образуя соли и выделяя водород. Например, цинк, железо, алюминий и др.
Как выглядит реакция азотной кислоты с металлом?
При реакции азотной кислоты с металлом происходит выделение пузырьков водорода. Цвет раствора меняется, и образуется соответствующая соль металла.
