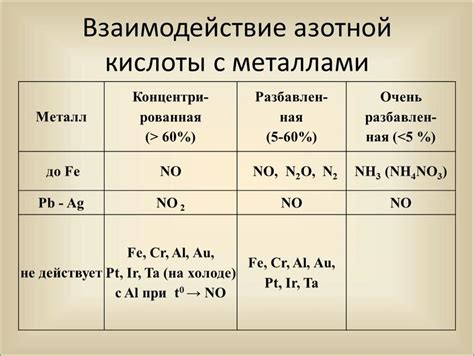
Реакция азотной кислоты с металлами является одной из важных химических реакций, которая находит широкое применение в различных областях науки и промышленности. Эта реакция проявляет несколько особенностей, которые зависят от типа металла, его степени окисления и концентрации азотной кислоты.
Азотная кислота (HNO3) – это сильная кислота, которая обладает высокой окислительной способностью. Она способна взаимодействовать с металлами, образуя соответствующие нитраты. Однако, реакция с каждым металлом происходит по-разному, и для разных металлов необходима разная концентрация азотной кислоты.
В таблице приведены основные металлы и реакции, которые они могут образовывать с азотной кислотой:
Металл
Реакция с азотной кислотой
Железо (Fe)
Образование железного(III) нитрата и выделение оксида азота
Медь (Cu)
Образование медного(II) нитрата и выделение оксида азота
Алюминий (Al)
Образование алюминиевого нитрата и выделение оксида азота
Серебро (Ag)
Образование серебряного нитрата и выделение оксида азота
Наряду с основными реакциями, возможны и другие типы взаимодействий металлов с азотной кислотой, например, образование гидроксидов металлов или нитритов. Некоторые металлы, такие как платина (Pt) или золото (Au), не реагируют с азотной кислотой в обычных условиях из-за низкой реакционной способности кислоты к этим металлам.
Реакция азотной кислоты с металлами имеет широкое практическое применение. Например, азотная кислота используется в металлургической промышленности для очистки и обработки металлических поверхностей, а также для приготовления различных сплавов. Кроме того, эта реакция часто используется в лаборатории для синтеза различных химических соединений.
Воздействие азотной кислоты на металлы: особенности и таблица

Азотная кислота, также известная как хладнокипящая кислота, обладает сильным окислительным действием и способна взаимодействовать с большинством металлов. Реакция между азотной кислотой и металлами может протекать с выделением газов и тепла, что делает ее опасной и требующей осторожности при обращении.
Особенности взаимодействия азотной кислоты с металлами зависят от их электрохимических свойств. Некоторые металлы, такие как медь и нержавеющая сталь, обладают достаточной устойчивостью к азотной кислоте и могут быть использованы в ее присутствии без серьезного повреждения. Однако большинство металлов реагируют с азотной кислотой, образуя соответствующие соли и оксиды металлов.
Ниже приведена таблица, иллюстрирующая реакцию азотной кислоты с некоторыми распространенными металлами:
| Металл | Реакция с азотной кислотой |
|---|---|
| Железо | Реакция с выделением азотного газа и образованием нитрата железа |
| Алюминий | Реакция с выделением аммиака и образованием нитрата алюминия |
| Свинец | Реакция с образованием нитрата свинца и выделением белого дыма |
Важно отметить, что реакция азотной кислоты с металлами может быть опасной и приводить к повреждению оборудования или травмам. Поэтому при работе с азотной кислотой необходимо соблюдать все меры предосторожности и проводить ее хранение и использование в соответствии с инструкциями производителя.
Металлы, взаимодействующие с азотной кислотой
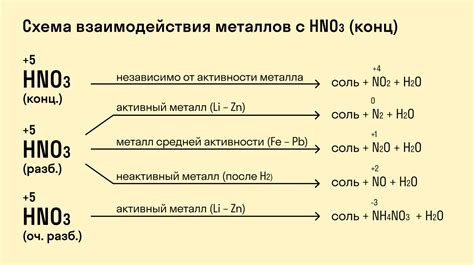
Азотная кислота является сильным окислителем и способна взаимодействовать с большим количеством металлов. Данная реакция обусловлена способностью азотной кислоты окислять металлы до их соответствующих ионов.
Некоторые металлы, такие как железо, цинк и алюминий, могут взаимодействовать с азотной кислотой, образуя соответствующие соли и выделяя газ – окись азота. Реакция происходит следующим образом: металл реагирует с азотной кислотой, образуя соответствующую соль и освобождая молекулы оксида азота II.
Однако некоторые металлы, такие как серебро и золото, не реагируют с азотной кислотой. Это связано с их высокой электроотрицательностью и устойчивостью к окислению. Кроме того, металлы такие, как медь и свинец, могут реагировать с азотной кислотой только при наличии специальных условий или в зависимости от концентрации кислоты.
Взаимодействие металлов с азотной кислотой является важным процессом, который используется в промышленности для получения различных соединений и солей. Кроме того, эта реакция имеет большое значение в области аналитической химии для определения наличия и концентрации металлов в различных образцах.
Химические реакции металлов с азотной кислотой
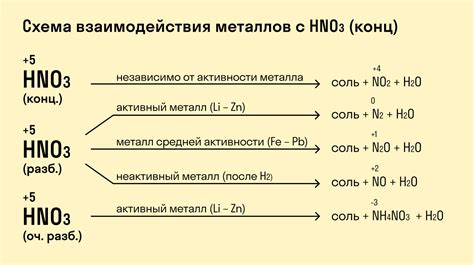
Химическая реакция металлов с азотной кислотой является одной из наиболее известных и показательных в химии. Азотная кислота (HNO3) обладает сильной окислительной способностью и способна реагировать с различными металлами.
В результате реакции с азотной кислотой, металлы могут образовывать различные продукты, в зависимости от их химической активности и концентрации кислоты. Например, активные металлы, такие как натрий, калий и магний, реагируют с азотной кислотой, образуя азотокислотую соль и выделяя диоксид азота и воду.
Менее активные металлы, такие как железо, цинк и алюминий, также могут реагировать с азотной кислотой, но результатом реакции будет образование соответствующих азотатов металлов и выделение диоксида азота и воды.
Однако, есть и металлы, которые не реагируют с азотной кислотой. К ним относятся медь, серебро и золото. Это связано с их низкой химической активностью и устойчивостью к окислению.
Таким образом, реакция металлов с азотной кислотой является важным иллюстрацией различного химического поведения металлов и их взаимодействия с окислителями.
Реакция металлов с различными концентрациями азотной кислоты
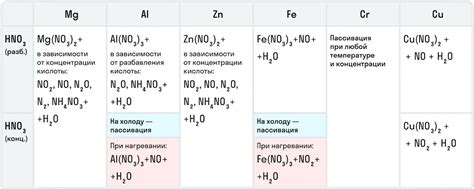
Металлы могут реагировать с азотной кислотой в зависимости от их активности и концентрации кислоты. Азотная кислота обладает окислительными свойствами и может оказывать влияние на различные металлы.
Слабоактивные металлы, такие как свинец или медь, обычно нереагируют с разбавленной азотной кислотой. Однако, при взаимодействии с концентрированной азотной кислотой, эти металлы могут растворяться. При этом выделяется оксид азота, который является одним из продуктов реакции.
Активные металлы, такие как цинк или железо, реагируют с азотной кислотой даже при ее разбавленной концентрации. В результате реакции образуются соответствующие соли металлов и оксид азота. Реакция активных металлов с азотной кислотой также сопровождается выделением газообразного азота.
Реакционная способность металлов с азотной кислотой может быть использована для их качественного определения. Она позволяет выделить идентифицировать определенный металл в присутствии других. Металлы можно классифицировать на основе их активности в реакции с азотной кислотой и использовать эту информацию для проведения различных химических экспериментов и анализов.
Таблица реакции металлов с азотной кислотой может включать следующую информацию:
- Название металла
- Реакция с разбавленной азотной кислотой
- Реакция с концентрированной азотной кислотой
Такая таблица позволяет наглядно представить различие в реакционной способности металлов с азотной кислотой в зависимости от их активности и концентрации кислоты.
Влияние температуры на реакцию металлов с азотной кислотой
Температура является одним из ключевых факторов, влияющих на реакцию металлов с азотной кислотой. Известно, что при повышении температуры происходит активация химических процессов и усиление реакций.
При нагревании металлов с азотной кислотой происходит окисление металла и образование азотных соединений. При этом можно наблюдать выделение газов, таких как окись азота и оксиды азота, а также образование соединений, содержащих ангидрид азотной кислоты - NO2 и N2O4.
Важно отметить, что при повышении температуры скорость реакции металла с азотной кислотой увеличивается. Это связано с тем, что при более высоких температурах металлы обладают большей энергией, что способствует активации химических связей и более интенсивному взаимодействию с кислотой.
Влияние температуры на реакцию металлов с азотной кислотой проявляется и в изменении продуктов реакции. При низких температурах образуются в основном нитраты, в то время как при более высоких температурах образуются более сложные и химически активные соединения.
Таким образом, температура является важным параметром, влияющим на реакцию металлов с азотной кислотой. Повышение температуры ускоряет реакцию и влияет на образование продуктов реакции, что важно учитывать при изучении данного химического процесса.
Получение соединений металлов с азотной кислотой

Азотная кислота (HNO3) является одним из наиболее активных окислителей в химии. Взаимодействие металлов с азотной кислотой приводит к образованию различных соединений. Реакция зависит от свойств металла и концентрации кислоты.
Металлы, такие как железо, никель, медь, свинец и алюминий, могут реагировать с азотной кислотой. Во время реакции металл окисляется, а азотная кислота восстанавливается. Процесс сопровождается выделением диоксида азота (NO2) и образованием соответствующих солей металла, например, нитратов.
Реакция между металлом и азотной кислотой может протекать экзотермически, сопровождаясь выделением тепла и образованием пузырей газа. При этом металл может полностью раствориться в кислоте или образовать покрытие оксидов на поверхности, которое защищает металл от дальнейшего действия азотной кислоты.
Для более точного определения характера реакции и составления прогноза необходимо учитывать не только свойства металла и концентрацию азотной кислоты, но и условия реакции (температуру, давление и другие факторы). Поэтому таблица реакций металлов с азотной кислотой может быть представлена в виде перечня с условиями и ограничениями.
Применение полученных соединений в промышленности

Соединения азотной кислоты с металлами активно применяются в различных отраслях промышленности. Их широкое применение обусловлено их высокой реакционной способностью и свойствами полученных соединений.
Одним из основных применений этих соединений является их использование в производстве удобрений. Азотные соединения, полученные при взаимодействии азотной кислоты с металлами, служат важным компонентом многих удобрений. Они способствуют активному росту и развитию растений, повышению их урожайности.
Кроме того, соединения азотной кислоты с металлами широко применяются в производстве взрывчатых веществ и пиротехнических изделий. Они обладают высокой стабильностью и возможностью энергетического высвобождения при окислительно-восстановительных реакциях. Применение таких соединений обеспечивает эффективность и безопасность взрывных материалов.
Также соединения азотной кислоты с металлами находят применение в производстве красителей и красок. Они обладают яркими и стойкими окрасками, что позволяет использовать их в различных областях дизайна и искусства.
В заключение, соединения азотной кислоты с металлами имеют широкое применение в промышленности, включая производство удобрений, взрывчатых веществ, красителей и красок. Их свойства и реакционная способность делают эти соединения важными компонентами в различных отраслях производства.
Преимущества и ограничения использования азотной кислоты в реакции с металлами
Преимущества:
- Азотная кислота является сильным окислителем и может быть использована для окисления различных металлов.
- Реакция азотной кислоты с металлами обычно происходит достаточно быстро и эффективно, что позволяет получать желаемый продукт без длительного ожидания.
- Использование азотной кислоты в реакции с металлами позволяет получать различные азотсодержащие соединения, которые могут иметь широкий спектр применений, включая в качестве катализаторов, удобрений или промышленных химикатов.
- Азотная кислота обладает высокой растворимостью в воде, что облегчает ее применение и дозировку в реакционной смеси.
Ограничения:
- Применение азотной кислоты в реакции с металлами требует тщательной осторожности, так как она является крайне коррозионной и может вызвать серьезные ожоги при контакте с кожей или глазами.
- Реакция азотной кислоты с некоторыми металлами может быть слишком взрывоопасной, поэтому требуется строгое соблюдение техники безопасности и правил работы с химическими веществами.
- Некоторые металлы могут быть неподходящими для реакции с азотной кислотой из-за их низкой реакционной способности или специфической химической структуры.
- Использование азотной кислоты может повлечь за собой образование нежелательных побочных продуктов, которые могут негативно повлиять на желаемый результат или влиять на безопасность процесса.
Вопрос-ответ

Какая реакция происходит между азотной кислотой и металлами?
Реакция азотной кислоты с металлами может различаться в зависимости от вида металла. Обычно происходит окислительно-восстановительная реакция, при которой металл окисляется, а азотная кислота восстанавливается. Результатом такой реакции часто является образование соли и выделение газа.
Какие металлы реагируют с азотной кислотой?
Реагентом в данном случае может быть как разбавленная азотная кислота (HNO3), так и концентрированная (HNO3) соответственно с водой. Из металлов можно выделить те, которые сравнительно плохо реагируют с азотной кислотой: свинец, медь, платина, серебро и золото. Более активные металлы, такие как железо, цинк, магний и алюминий реагируют быстрее и более интенсивно.
Что происходит при реакции азотной кислоты с алюминием?
При реакции азотной кислоты с алюминием происходит окислительно-восстановительная реакция. Алюминий окисляется до ионов Al^3+, а азотная кислота восстанавливается до оксида азота (II) (NO). В результате образуется алюминиевая соль - нитрат алюминия, и выделяется газ - оксид азота (II). Реакция протекает при образовании вспышек и шума.
