Азотная кислота, или азотный(V) оксид, является одной из наиболее распространенных искусственных кислот. Её формула HNO3 говорит о том, что эта кислота состоит из атома водорода (H), атома азота (N) и трех атомов кислорода (O).
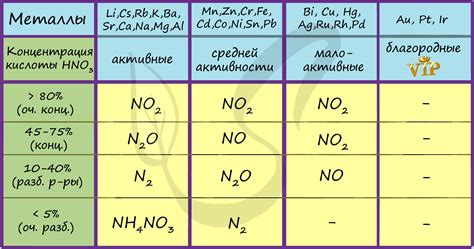
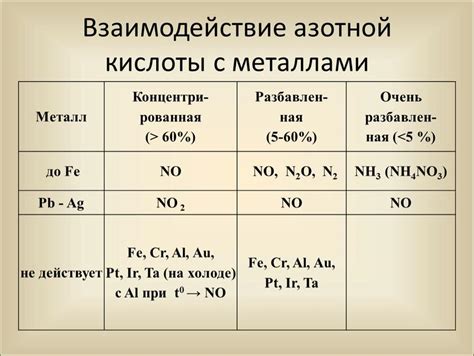
Взаимодействие азотной кислоты с металлами обладает своими особенностями. Кислота проявляет свои химические свойства при контакте с определенными металлами, такими как медь (Cu), железо (Fe), цинк (Zn) и другими.
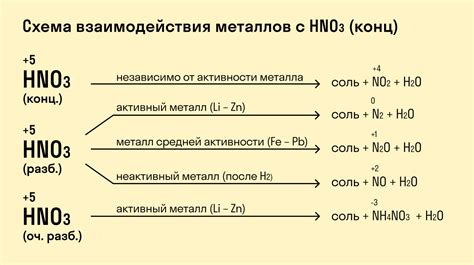
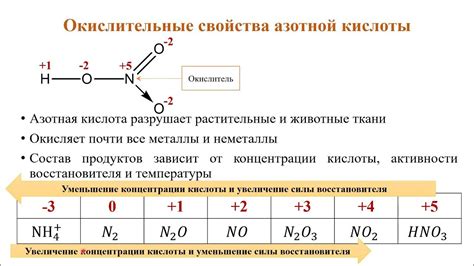
При взаимодействии азотной кислоты с металлами, последние подвергаются окислению, образуя нитраты или азотаты. Окисление металлов приводит к образованию ионов металла и, в некоторых случаях, выделению избыточного кислорода. Это взаимодействие является быстрой и обратимой реакцией, позволяющей получить различные металлические соли, которые имеют свои уникальные свойства и применение в различных областях науки и промышленности.
Интересно отметить, что азотная кислота, благодаря своим окислительным свойствам, является основным компонентом при производстве взрывчатых веществ, а также используется в процессе гальванизации металлов и в других химических реакциях.
Взаимодействие азотной кислоты с металлами

Азотная кислота (HNO3) - это сильная кислота, которая показывает высокую реактивность и способна взаимодействовать с различными металлами.
При контакте с металлами, азотная кислота образует нитраты, соли, содержащие анионы NO3-. Это происходит из-за высокой окислительной способности кислоты, которая позволяет ей окислять металлы до более высоких окислительных состояний.
Процесс взаимодействия азотной кислоты с металлами может быть сопровожден выделением диоксида азота и природными газами, что делает его не только реактивным, но и довольно опасным.
Взаимодействие азотной кислоты с металлами имеет широкое применение в различных областях, включая производство удобрений, производство взрывчатых веществ, а также для очистки и покрытия поверхностей металлов.
Особенности реакции азотной кислоты с металлами
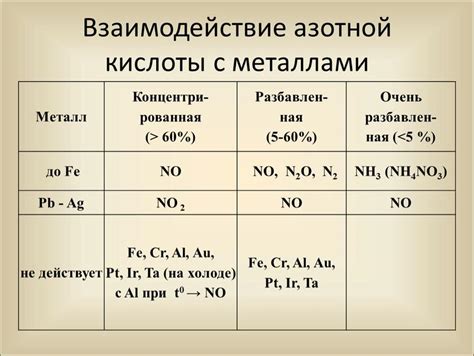
Реакция азотной кислоты с металлами является химическим процессом, в результате которого образуется нитрат металла. Эта реакция имеет несколько особенностей, которые следует учитывать при изучении и использовании азотной кислоты в химических процессах.
Во-первых, азотная кислота является сильным окислителем и способна окислить металлы. При этом происходит передача электронов от металла к кислороду азотной кислоты, что приводит к образованию ионов металла с положительным зарядом. Это позволяет использовать азотную кислоту при получении нитратов различных металлов.
Во-вторых, реакция азотной кислоты с металлами происходит с выделением газов. В результате окисления металла образуются оксиды и нитроксиды, которые могут выделяться в виде газа. Например, при реакции азотной кислоты с медью образуется нитрат меди и выделяется коричневый газ NO2.
Также следует отметить, что реакция азотной кислоты с металлами может протекать с выделением тепла и шума. Это связано с интенсивностью окислительных процессов, которые происходят при взаимодействии азотной кислоты с металлом. Поэтому при использовании азотной кислоты необходимо соблюдать меры предосторожности и работать в специально оборудованных помещениях.
В заключение, реакция азотной кислоты с металлами является важным химическим процессом, который позволяет получать нитраты различных металлов. Однако при использовании азотной кислоты необходимо учитывать ее окислительные свойства, выделение газов, а также соблюдать меры безопасности.
Влияние металлов на химические свойства азотной кислоты
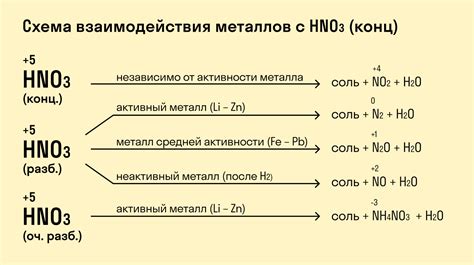
Азотная кислота (HNO3) является одним из наиболее распространенных и важных химических соединений, применяемых в различных отраслях промышленности. Способность азотной кислоты взаимодействовать с металлами имеет важное значение для понимания ее химических свойств и применения в различных процессах.
Металлы могут оказывать влияние на химические свойства азотной кислоты в результате образования с ней соединений или изменения степени окисления азота в кислоте. Например, некоторые металлы, такие как железо и медь, могут окисляться азотной кислотой, что приводит к образованию соответствующих оксидов металла и окислителей азота, таких как оксид азота IV (NO2) и пентоксид азота (N2O5).
Взаимодействие азотной кислоты с металлами может быть использовано в различных промышленных процессах. Например, азотная кислота может использоваться для очистки поверхности металлического изделия перед нанесением защитного покрытия или для удаления окислов с поверхности металла. Также, азотная кислота может применяться в производстве удобрений, где она используется для получения азотных соединений, необходимых для роста растений.
Практическое применение реакции с металлами

Одно из практических применений реакции азотной кислоты с металлами - получение нитратов. Нитраты широко используются в сельском хозяйстве в качестве удобрений. Например, нитрат аммония (NH4NO3) является одним из наиболее распространенных и эффективных удобрений, которое обеспечивает растениями азот для их полноценного роста и развития. Отличная растворимость нитратов позволяет использовать их как быстродействующие удобрения, которые обеспечивают важный макроэлемент - азот - растениям в кратчайшие сроки.
Кроме использования в сельском хозяйстве, реакция азотной кислоты с металлами находит применение в производстве взрывчатых веществ. Нитроглицерин, к примеру, получается в результате реакции глицерина с азотной кислотой. Это высокоэнергетическое соединение применяется в производстве тротила, который сам является одним из наиболее широко используемых взрывчатых веществ. Впоследствии, тротил используется в промышленности при производстве взрывчатых веществ, в том числе и для военных целей.
Другим применением реакции азотной кислоты с металлами является получение азотной кислоты благодаря нитратам. Одним из важных применений азотной кислоты в промышленности является ее использование в производстве азотной кислоты. Нитраты, такие как нитрат аммония или нитрат калия, подвергаются депросткалению, в результате которого образуется азотная кислота. Азотная кислота в дальнейшем может быть использована в производстве различных химических соединений, в производстве пластмасс, в качестве растворителя и т.д.
Примеры использования азотной кислоты в промышленности
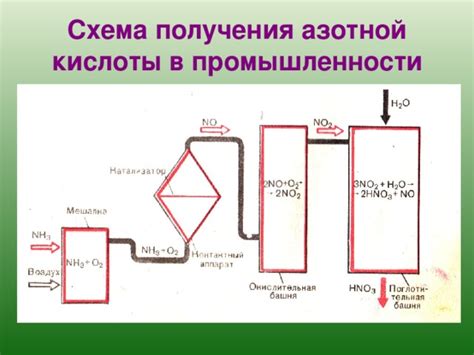
Азотная кислота (HNO3) является одной из наиболее распространенных и важных химических соединений, широко используемых в промышленности. Она имеет множество применений благодаря своим уникальным физическим и химическим свойствам.
Одним из главных примеров использования азотной кислоты является ее применение в производстве удобрений. Путем реакции азотной кислоты с аммиаком получают азотные удобрения, которые используются для повышения урожайности и качества сельскохозяйственных культур. Азотные удобрения, такие как аммиак, нитрат аммония и нитрат калия, являются ключевым компонентом современного сельского хозяйства.
Другим примером использования азотной кислоты является ее применение в производстве взрывчатых веществ. Азотная кислота служит основным компонентом для производства тринитроглицерина (ТНГ), который является основным взрывчатым веществом в динамите и других взрывных материалах. Также азотная кислота используется для создания азотной кислоты в промышленных масштабах, такие как азотнокислотное удобрение.
Еще одним важным примером использования азотной кислоты является ее применение в производстве полимеров и пластмасс. Азотная кислота используется в процессе нитрования в производстве нитроцеллюлозы, которая является основным компонентом для производства пластмасс, пленок и других продуктов, используемых в промышленных и бытовых целях.
Вопрос-ответ

Что такое азотная кислота?
Азотная кислота, также известная как серная кислота, является химическим соединением, состоящим из атомов азота и кислорода, со структурной формулой HNO3. Она относится к классу минеральных кислот и является сильным окислителем и коррозионным агентом. В естественном виде азотная кислота существует в жидком состоянии и имеет прозрачный или слегка желтоватый цвет.
Как происходит взаимодействие азотной кислоты с металлами?
Азотная кислота взаимодействует с металлами, образуя нитраты. При этом происходит окисление металла, а сама кислота восстанавливается. Реакция между азотной кислотой и металлом проходит с выделением диоксида азота и воды.
Какие металлы реагируют с азотной кислотой?
Азотная кислота может взаимодействовать с большинством металлов, включая железо, алюминий, медь, цинк, свинец и др. Однако реакция с каждым металлом будет иметь свои особенности, так как реакционная активность металлов различна.
Какие особенности имеет взаимодействие азотной кислоты с металлами?
Одной из особенностей взаимодействия азотной кислоты с металлами является образование нитратов. В реакции образуются растворимые соли нитратов металлов, которые могут быть использованы в различных отраслях промышленности, например, в производстве удобрений и взрывчатых веществ. Кроме того, данная реакция может применяться для очистки металлических поверхностей от оксидов и прочих загрязнений.
Какие есть применения взаимодействия азотной кислоты с металлами?
Взаимодействие азотной кислоты с металлами имеет широкий спектр применений. Нитраты, образуемые в результате реакции, используются в производстве удобрений для повышения урожайности растений. Кроме того, нитраты могут служить сырьем для производства взрывчатых веществ и пиротехнических композиций. Также, взаимодействие азотной кислоты с металлами может применяться для очистки и обработки металлических поверхностей.