Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Характерной особенностью атомов щелочных металлов является наличие всего одного валентного электрона во внешней электронной оболочке. Это делает их атомы очень реакционноспособными и активными химическими элементами.
Валентный электрон – это электрон, находящийся в самом внешнем энергетическом уровне атома. У атомов щелочных металлов с одним валентным электроном этот уровень называется s-орбиталью. Благодаря наличию всего одного валентного электрона, атомы щелочных металлов имеют тенденцию активно взаимодействовать с другими элементами, стремясь передать или принять электроны, чтобы достичь стабильной конфигурации внешней оболочки.
Атомы щелочных металлов обладают высокой электроотрицательностью, что делает их способными легко отдавать валентный электрон и образовывать положительные ионы. После потери валентного электрона атомы щелочных металлов приобретают положительный заряд, который компенсируют негативно заряженные электроны внутренних оболочек. Это делает ионы щелочных металлов стабильными и способными к образованию ионных связей с отрицательно заряженными атомами или ионами других элементов.
Валентные электроны в атомах щелочных металлов
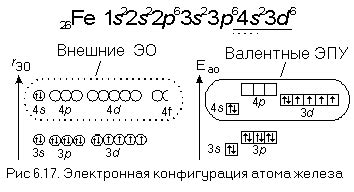
Атомы щелочных металлов, таких как литий, натрий, калий и т.д., имеют особенности в своей электронной структуре, связанные с наличием одного валентного электрона. Валентные электроны - это электроны в самом высоком энергетическом уровне атома, которые определяют химические свойства элемента.
В щелочных металлах валентный электрон находится на s-орбитали, которая имеет форму сферы. Эти атомы обладают высокой реактивностью, так как единственный валентный электрон легко отделяется и участвует в химических реакциях. Поэтому щелочные металлы являются сильными восстановителями.
Валентный электрон в атоме щелочного металла может быть передан в качестве электронного донора другому атому или иону, образуя ионный металлический связанный комплекс. Это объясняет способность щелочных металлов образовывать стабильные ионы положительного заряда. В молекулярных соединениях щелочных металлов, валентный электрон может образовывать ковалентные связи с другими атомами, образуя различные химические соединения.
В общем, валентные электроны в атомах щелочных металлов играют ключевую роль в определении их химических свойств и реактивности. Изучение этих особенностей позволяет понять многие аспекты химии щелочных металлов и использовать их в различных приложениях, включая батареи, катализ и многое другое.
Атомы щелочных металлов

Атомы щелочных металлов являются особыми из-за наличия у них одного валентного электрона во внешней энергетической оболочке. Это отличает их от других элементов и определяет их химические свойства.
Валентный электрон у атомов щелочных металлов находится в s-подобной орбитали, что делает его легко доступным для участия в химических реакциях. Из-за этого щелочные металлы очень активны и реагируют с большинством веществ.
Само название "щелочные металлы" связано с тем, что они образуют гидроксиды, обладающие щелочными свойствами. Благодаря этим свойствам, щелочные металлы широко используются в различных отраслях, включая промышленность, медицину и науку.
Одним из ключевых свойств атомов щелочных металлов с одним валентным электроном является их способность образовывать ионные соединения. В химических реакциях они удаляют свой валентный электрон, образуя положительные ионы. Это дает им возможность образовывать соли и другие ионные соединения с отрицательно заряженными анионами.
- Другим важным свойством атомов щелочных металлов является их реактивность с воздухом и водой. Благодаря высокой реактивности валентного электрона, они быстро окисляются воздухом, а также реагируют с водой, образуя щелочные растворы и выделяя водородный газ.
- Атомы щелочных металлов также обладают высокой электропроводностью из-за наличия свободного валентного электрона. Это позволяет им быть хорошими проводниками электричества, что находит применение в различных электронных устройствах и батареях.
Особенности атомов с одним валентным электроном

1. Низкая энергия ионизации: Щелочные металлы, такие как литий, натрий, калий, обладают особенностью иметь только один валентный электрон, находящийся на самом внешнем энергетическом уровне атома. Это делает их атомы относительно большими и слабо связанными с ядром, что приводит к низкой энергии ионизации. При этом, эти атомы легко отделяют свой единственный валентный электрон, образуя положительный ион и приобретая свойство химически активных металлов.
2. Высокая реактивность: Атомы щелочных металлов с одним валентным электроном обладают высокой реактивностью из-за желания стабилизироваться, получив восемь электронов на своем внешнем энергетическом уровне. Из-за этого они легко вступают в реакцию с другими элементами, образуя ионы с отрицательным зарядом и устойчивое октетное строение. Щелочные металлы активно реагируют с водой, кислородом и другими неметаллами, образуя соответствующие химические соединения.
3. Химическая активность: Щелочные металлы с одним валентным электроном обладают высокой химической активностью. Они легко окисляются, образуя положительные ионы, и образуют стабильные ионные соединения с отрицательно заряженными неметаллами. Щелочные металлы активно взаимодействуют с влажным воздухом, водой и огнем. Их соединения широко используются в различных областях химии, металлургии, электротехнике и других отраслях промышленности.
4. Положительное ионное заряд: Поскольку атомы щелочных металлов с одним валентным электроном имеют тенденцию потерять этот электрон, они образуют ионы с положительным зарядом. Положительные ионы щелочных металлов легко вступают в реакцию с отрицательно заряженными ионами, образуя стабильные ионные соединения.
5. Мягкость и химическая реактивность: Щелочные металлы с одним валентным электроном характеризуются мягкостью и низкой температурой плавления. Их атомы слабо связаны в кристаллической решетке и легко сдвигаются друг относительно друга. Это приводит к мягкости металла и высокой химической реактивности. Они также обладают хорошей электропроводностью и теплопроводностью, что делает их полезными в различных электротехнических и термических приложениях.
Роль валентных электронов в химических реакциях
Валентные электроны играют ключевую роль во всех химических реакциях, включая реакции, в которых участвуют атомы щелочных металлов с одним валентным электроном. Эти электроны находятся на самом внешнем энергетическом уровне атома и определяют его химические свойства.
Валентные электроны в атоме щелочного металла могут участвовать в различных типах химических связей с другими атомами. Они могут образовывать ионные связи, при этом отдавая свой валентный электрон и образуя положительный ион, или могут участвовать в ковалентной связи, при этом электрон пары между двумя атомами щелочных металлов общая.
Валентные электроны также могут образовывать металлическую связь, при которой они образуют "общий" электронный облако, через которое атомы щелочных металлов связаны друг с другом.
Валентные электроны в щелочных металлах также могут участвовать в реакциях с другими веществами, в результате которых образуются новые химические соединения. Такие реакции могут протекать с выделением тепла и света, они являются основой для многих применений щелочных металлов в различных отраслях науки и техники.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
Щелочными металлами называются элементы, которые находятся в первой группе периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Чем отличаются атомы щелочных металлов от других атомов?
Основное отличие атомов щелочных металлов от других атомов заключается в наличии одного валентного электрона на внешней энергетической оболочке.
Каковы особенности взаимодействия атомов щелочных металлов с другими элементами?
Атомы щелочных металлов очень активны химически и склонны образовывать ионные связи с другими элементами. Их валентный электрон легко отдаётся, что позволяет образовывать положительно заряженные ионы. Это делает атомы щелочных металлов отличными веществами для реакций с водой и другими веществами.
