Возможность атомов металлов выступать в роли восстановителей обусловлена их особыми физическими и химическими свойствами. Атомы металлов обладают свободно движущимися электронами в своей внешней оболочке, которые легко могут передаваться другим атомам. Это позволяет металлам обеспечивать потеря или получение электронов в химических реакциях, что является основой процесса восстановления.
Кроме того, атомы металлов обладают низкой электроотрицательностью, что означает их большую склонность отдавать электроны другим атомам. Это делает металлы эффективными восстановителями, поскольку они способны отдавать электроны окислителям, снижая их окислительную способность.
Благодаря высокой подвижности своих электронов и низкой электроотрицательности, атомы металлов могут превратиться из ионов более высокой степени окисления в ионы более низкой степени окисления путем передачи электронов. Это происходит в процессе восстановления, при котором электроны передаются от металла к окислителю, позволяя окислителю снизить свою степень окисления.
Атомы металлов являются восстановителями

Металлы – это вещества, которые обладают способностью легко отдавать электроны и образовывать положительно заряженные ионы.
Эта особенность делает атомы металлов отличными восстановителями, так как они способны передавать электроны другим веществам, которые находятся в окружающей среде.
Процесс передачи электронов, который сопровождается изменением окислительного состояния вещества, называется окислительно-восстановительной реакцией или окислением-восстановлением.
Атомы металлов, отдавая свои электроны, позволяют другим веществам принять эти электроны и таким образом становятся восстановителями в окислительно-восстановительной реакции.
Эта способность металлов играет важную роль во многих процессах, таких как коррозия металлов, электрохимические реакции и процессы в живых организмах.
В электролизе, восстановительной очистке воды и в процессах синтеза соединений, атомы металлов используются как восстановители, способные образовывать новые химические соединения.
Также атомы металлов играют важную роль в живых организмах, где они участвуют в электронном транспорте, в процессах дыхания и фотосинтеза.
Таким образом, атомы металлов являются восстановителями благодаря своей способности отдавать электроны и участвовать в окислительно-восстановительных реакциях, которые играют важную роль в химии и биологии.
Металлическая структура атомов

Металлы обладают особыми свойствами благодаря своей уникальной структуре атомов. Атомы металлов образуют кристаллическую решетку, в которой они располагаются в регулярном порядке. Такая структура позволяет атомам металлов обмениваться электронами с легкостью, что делает их хорошими восстановителями.
Каждый атом металла имеет одну или несколько валентных электронных оболочек, которые могут свободно перемещаться между соседними атомами в кристаллической решетке. Эти свободные электроны называются электронами проводимости. Они играют важную роль в проводимости тепла и электричества в металлах.
Структура атомов металлов также делает их хорошими восстановителями. Восстановитель – это вещество, которое способно передавать электроны другим веществам. При взаимодействии с окислителем атомы металлов способны отдать свои электроны и превратиться в ионы с положительным зарядом. Это позволяет окислителю получить электроны и восстановить свою структуру.
Металлическая структура атомов способствует образованию ионов в металлах, что делает их хорошими восстановителями. Это свойство широко используется в химических реакциях, процессах электролиза, а также в производстве различных металлических изделий.
Электронная конфигурация металлических атомов

Атомы металлов обладают особой электронной конфигурацией, которая определяет их химические и физические свойства. Ключевыми особенностями электронной конфигурации металлических атомов являются наличие недостаточного количества электронов в заполненных энергетических уровнях и наличие одного или нескольких электронов в не заполненном d- или f-подуровнях.
Отсутствие полностью заполненных энергетических уровней делает атомы металлов восстановителями. Такие атомы стремятся отдать свои электроны, чтобы достичь стабильного состояния с полностью заполненными энергетическими уровнями. Поэтому металлы обладают свойствами хороших восстановителей и легко взаимодействуют с другими веществами, в том числе с кислородом, окисляясь.
Дополнительно, не все атомы металлов имеют заполненные энергетические уровни только s- и p-подуровней. Некоторые металлы, такие как переходные металлы, имеют также заполненные d-подуровни, а некоторые элементы блока f - имеют заполненные f-подуровни. Наличие электронов в не заполненных d- и f-подуровнях придает металлам особые свойства, например, способность образовывать различные ионные состояния и формировать комплексные соединения.
В целом, электронная конфигурация металлических атомов определяет их реакционную способность и способность взаимодействовать с другими веществами. Понимание этих особенностей является важным фактором для понимания и изучения химического поведения металлов.
Потеря электронов и реакция окисления-восстановления

Атомы металлов могут выступать в качестве восстановителей в химических реакциях, так как они имеют тенденцию потерять электроны. Это связано с особенностями их электронной структуры.
В атоме металла на внешнем энергетическом уровне находится от одного до трех электронов. Благодаря этому, в процессе реакции окисления-восстановления, атомы металлов способны отдавать электроны, что приводит к процессу окисления.
Восстановитель - это вещество, которое способно отдавать электроны. Атом металла, потерявший один или несколько электронов, становится ионом положительной заряды.
Ионные уравнения окисления-восстановления позволяют описать процессы передачи электронов между веществами. В этих уравнениях показывается, какие вещества окисляются, а какие вещества восстанавливаются. Атомы металлов, действуя в качестве восстановителей, способствуют восстановлению других веществ, принимая на себя лишние электроны.
Важно отметить, что в реакциях окисления-восстановления необходимо сохранение электронного баланса. То есть, количество потерянных электронов атомами металлов должно быть равно количеству полученных электронов другими веществами.
Таким образом, атомы металлов являются восстановителями в реакциях окисления-восстановления благодаря своей способности отдавать электроны и способствовать восстановлению других веществ.
Связь между восстановительными свойствами атомов металлов и их электроотрицательностью
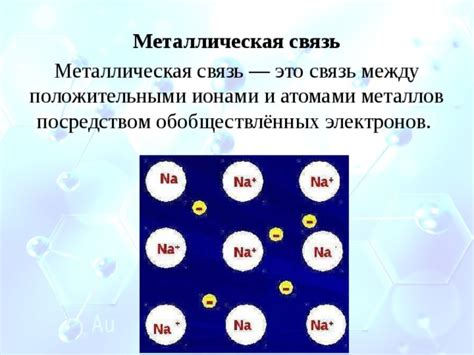
Атомы металлов обладают восстановительными свойствами благодаря их электроотрицательности.
Электроотрицательность - это химическая характеристика, определяющая способность атома притягивать к себе электроны в химической связи.
Атомы металлов отличаются низкой электроотрицательностью, что связано с их благоприятной электронной конфигурацией. У металлов на внешней энергетической оболочке находится мало электронов, что создает благоприятные условия для отдачи электронов и образования положительных ионов.
Из-за низкой электроотрицательности атомы металлов способны передавать свои электроны другим атомам, что делает их восстановителями во многих химических реакциях. Когда металлический атом отдает электроны, происходит окисление, а вещество, получающее электроны, подвергается восстановлению.
Восстановительные свойства атомов металлов также связаны с их способностью образовывать положительные ионы с малым радиусом, что их делает более активными в химических реакциях. Из-за этого металлы способны взаимодействовать с окислителями и передавать свои электроны, что приводит к восстановлению окислителей и образованию положительных соединений.
Таким образом, низкая электроотрицательность атомов металлов связана с их восстановительными свойствами. Они обладают способностью отдавать свои электроны и взаимодействовать с окислителями, что делает их важными участниками многих химических реакций и процессов.
Электрохимический ряд металлов

Электрохимический ряд металлов представляет собой упорядоченный список металлов по их способности восстановливать положительные ионы из растворов. Чем выше металл на ряду, тем большую способность он имеет к восстановлению. В основе электрохимического ряда лежит способность атомов металлов отдавать электроны и образования ионов с положительным зарядом.
Восстановительная способность атомов металлов обусловлена их электроотрицательностью и энергией ионизации. Металлы, имеющие более низкую электроотрицательность и более низкую энергию ионизации, проявляют большую способность к восстановлению. Такие металлы являются сильными восстановителями в химических реакциях.
На основе электрохимического ряда металлов можно определить их относительную активность в различных химических реакциях. Металлы, расположенные выше по ряду, способны отдавать электроны и вступать в реакции восстановления с ионами других металлов, при этом сами превращаясь в ионы. Металлы, расположенные ниже по ряду, не способны превращаться в ионы и не проявляют восстановительной активности.
С помощью электрохимического ряда металлов можно определить направление потока электронов в электрохимических реакциях. Металлы, находящиеся в верхней части ряда, будут вести себя как восстановители и будут отдавать электроны. Металлы, находящиеся в нижней части ряда, будут вести себя как окислители и будут принимать электроны. Электрохимический ряд металлов является важным инструментом в химии и электрохимии для анализа и понимания реакций, связанных с передачей электронов.
Применение восстановительных свойств атомов металлов
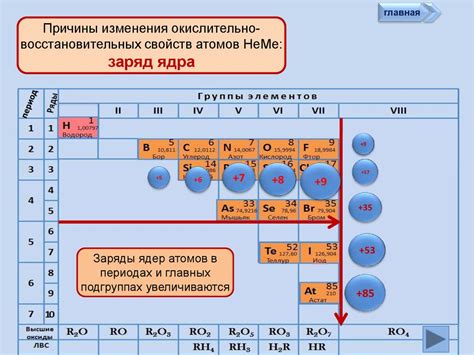
Атомы металлов являются восстановителями в химических реакциях благодаря своей способности отдавать электроны. Это явление находит широкое применение в различных сферах науки и техники.
Одной из практических областей, где используются восстановительные свойства атомов металлов, является электрохимия. Атомы металлов, особенно таких элементов, как железо, алюминий и цинк, способны отдавать электроны и образовывать ионы. Это позволяет им участвовать в различных электрохимических процессах, таких как гальваническая коррозия и электролиз. На основе этих процессов разрабатываются различные средства защиты металлических конструкций от коррозии и производство электричества.
Восстановительные свойства атомов металлов также находят применение в химическом анализе и синтезе веществ. Например, при проведении реакций окисления и восстановления, атомы металлов выступают в качестве восстановителей или окислителей. Это помогает получать ценные соединения, такие как препараты и лекарства, а также проводить анализ различных веществ.
Помимо этого, восстановительные свойства атомов металлов применяются в электронике и энергетике. Например, литий-ионные аккумуляторы, которые широко используются в электронных устройствах, работают на основе восстановительных свойств лития. Атомы лития способны отдавать электроны и создавать электрический потенциал, который используется для хранения энергии. Также восстановительные свойства металлов применяются в процессах генерации электроэнергии, таких как термоядерный синтез и ядерные реакторы.
В заключение, восстановительные свойства атомов металлов находят применение во множестве областей науки и техники. Это свойство позволяет атомам металлов играть важнейшую роль в электрохимических процессах, химическом анализе и синтезе веществ, а также электронике и энергетике. Благодаря этому восстановительные свойства атомов металлов являются ключевыми для развития многих сфер нашей жизни.
Влияние восстановителей на окружающую среду

Атомы металлов являются восстановителями, то есть способны передавать электроны и восстанавливать другие вещества, которые находятся в окружающей среде. Влияние восстановителей на окружающую среду может быть как положительным, так и отрицательным.
Положительное влияние восстановителей на окружающую среду проявляется, например, в промышленных процессах, где они используются для утилизации и очистки различных отходов. Атомы металлов могут вступать в реакцию с токсичными веществами, превращая их в менее опасные соединения. Таким образом, восстановители помогают снизить загрязнение окружающей среды и улучшить ее качество.
Однако, применение восстановителей также может иметь и отрицательные последствия. Например, в результате процессов восстановления металлами могут образовываться отходы, которые сами по себе являются опасными для окружающей среды. Если такие отходы необрабатываются или утилизируются неправильно, они могут привести к загрязнению почвы, воды и атмосферного воздуха.
Кроме того, применение некоторых восстановителей может иметь побочные эффекты на окружающую среду. Например, использование некоторых металлов в качестве восстановителей может приводить к выбросам вредных веществ в атмосферу или образованию токсичных отходов, которые сложно утилизировать или очистить.
Таким образом, влияние восстановителей на окружающую среду зависит от того, как они применяются. Правильное использование восстановителей может помочь снизить уровень загрязнения окружающей среды и способствовать ее улучшению. Однако, необходимо учитывать и возможные негативные последствия и заботиться о безопасности окружающей среды при использовании восстановителей.
Вопрос-ответ

Почему атомы металлов являются восстановителями?
Атомы металлов являются восстановителями, так как они обладают свободными электронами во внешней оболочке, которые легко могут передавать другим веществам электроны. При этом атомы металлов сами окисляются, теряя электроны и образуя положительно заряженные ионы.
Почему атомы металлов являются хорошими восстановителями?
Атомы металлов являются хорошими восстановителями, потому что они имеют низкую электроотрицательность и способны легко отдавать свои электроны. Это связано с особым строением атомов металлов, где внешняя электронная оболочка слабо притягивается ядром атома. Благодаря этому, атомы металлов могут передавать свои электроны другим веществам, что и является проявлением их восстановительных свойств.
Какие свойства атомов металлов делают их восстановителями?
Атомы металлов обладают несколькими свойствами, которые позволяют им быть хорошими восстановителями. Во-первых, атомы металлов имеют низкую электроотрицательность, что означает, что они слабо притягивают электроны к себе и могут легко отдавать их другим веществам. Во-вторых, атомы металлов имеют свободные электроны во внешней оболочке, которые легко могут передавать другим атомам. И, наконец, атомы металлов способны образовывать положительно заряженные ионы, когда они теряют свои электроны.
