Металлы являются одной из основных групп химических элементов и обладают рядом уникальных свойств. Одной из ключевых характеристик атомов металлов является их способность образовывать положительные ионы, отдавая электроны другим элементам. Это объясняется особенностями электронной структуры металлов, которая характеризуется особым расположением электронов в атоме.
Электроны - негативно заряженные элементарные частицы, движущиеся вокруг ядра атома. В атоме металла электроны располагаются в энергетических оболочках, которые представляют собой энергетические уровни. Атомы металлов могут иметь различное количество оболочек и электронов, что зависит от их атомного номера и положения в периодической системе элементов.
Особенность электронной структуры атомов металлов заключается в наличии нескольких электронных оболочек и большого количества свободных электронов.
Положительная заряженность ядра атома металла притягивает к себе отрицательно заряженные электроны. Однако, внешний энергетический уровень, на котором находятся валентные электроны, отличается от внутренних оболочек. Это обеспечивает возможность выхода валентных электронов из атома, что и является основной причиной металлического свойства проводить электрический ток.
Атомы металлов
Атомы металлов являются основными строительными блоками металлических материалов и обладают рядом характеристик, влияющих на их свойства и поведение.
Первое, что необходимо отметить, это то, что атомы металлов имеют относительно большой размер и массу по сравнению с другими элементами в периодической таблице. Это связано с их электронной структурой, которая обеспечивает наличие внутренней оболочки, называемой заполненной энергетической уровневой оболочкой, и внешней оболочки, содержащей меньше электронов, чем есть мест. Именно такая структура делает атомы металлов готовыми к обмену электронами и обеспечивает их металлические свойства.
Кроме того, атомы металлов обладают высокой плотностью электронной оболочки, которая обеспечивает металлическую связь. Свободные электроны в металлах могут двигаться легко и свободно между атомами, что делает эти материалы хорошими проводниками электричества и тепла.
Атомы металлов также обладают высокой способностью к кристаллизации, то есть способностью образовывать регулярные трехмерные узоры (кристаллическую решетку). Это объясняет прочность и твердость металлов, а также их возможность образования разнообразных структур при взаимодействии с другими элементами.
- Соответственно, атомы металлов играют важную роль в формировании свойств металлических материалов и определяют их прочность, электропроводность и другие характеристики.
- Электронная структура атомов металлов имеет свои особенности и является основой металлических свойств.
- Свободные электроны и кристаллическая решетка являются ключевыми элементами металлической связи и определяют основные свойства металлов.
Электроны в атомах металлов

Атом металла состоит из ядра и облака электронов. Ядро содержит протоны и нейтроны, а облако электронов находится вокруг ядра на разных энергетических уровнях.
Электроны в атомах металлов имеют особые характеристики. Они обладают отрицательным электрическим зарядом и движутся по орбитальным траекториям. В металлах электроны образуют свободные электронные газы, которые могут перемещаться по всей структуре металла.
Для металлов характерна наличие малого количества электронов на внешнем энергетическом уровне, что делает атомы металлов химически активными и способными образовывать химические связи с другими атомами. Однако благодаря наличию свободных электронов, металлы обладают определенными металлическими свойствами, такими как электропроводность и теплопроводность.
Свободные электроны в металлах могут также перемещаться под влиянием электрического поля, что позволяет металлам быть отличными проводниками электричества. Благодаря этому свойству металлы находят широкое применение в различных областях, таких как производство электроники, электромеханики и электротехники.
Химические соединения
Химическое соединение представляет собой вещество, состоящее из двух или более элементов, объединенных химической связью. В таких соединениях атомы металлов и их электроны играют важную роль.
Химические соединения могут быть неорганическими или органическими. Неорганические соединения образуются при реакциях между атомами металлов и неметаллами. Они часто обладают ионными связями и образуют кристаллическую решетку. Органические соединения содержат углерод, который может образовывать связи со множеством других элементов, включая металлы.
Соединения металлов могут иметь разные степени окисления, что влияет на их химические свойства. Например, в многих оксидах металлов кислород имеет степень окисления -2, а металлы - положительные степени окисления. Эти соединения являются основными компонентами руды и используются в металлургической промышленности для получения металлического металла.
Химические соединения металлов широко используются в различных отраслях промышленности. Они могут быть использованы для создания сплавов и легирования металлов, а также для производства различных материалов, таких как керамика, стекло и пластик.
Кроме того, многие химические соединения металлов обладают уникальными свойствами, такими как способность проводить ток, отражать свет или обладать магнитными свойствами. Эти свойства делают эти соединения полезными в электронике, оптике и магнитной технологии.
Реакционная способность металлов

Реакционная способность металлов определяется их внешней электронной конфигурацией и положением в периодической системе. Металлы стремятся образовать ионы положительного заряда, отдавая один или несколько электронов. Это связано с тем, что в атоме металла валентная оболочка содержит мало электронов, а их удаление приводит к повышению устойчивости системы.
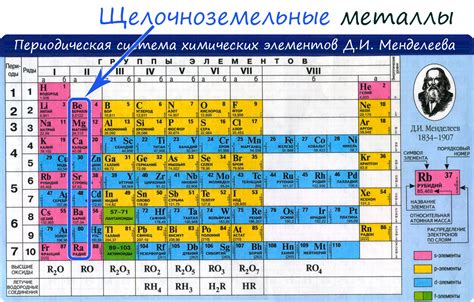
Наиболее реакционно способные металлы находятся слева от периодической системы, такие как литий, натрий, калий и другие щелочные и щелочноземельные металлы. Они легко отдают свои электроны и образуют ионы с положительным зарядом. Эта реакционная способность связана с низкой энергией ионизации и электроотрицательностью элементов.
Металлы также способны реагировать с кислотами, образуя соли и выделяя водород. Например, цинк реагирует с соляной кислотой в результате образования хлорида цинка и выделения водорода:
- Zn + 2HCl → ZnCl2 + H2
Металлы могут также реагировать с кислородом и образовывать оксиды. Реакционная способность зависит от положения металла в ряду активности металлов. Например, цезий реагирует с кислородом при обычных условиях, образуя оксид цезия:
- 4Cs + O2 → 2Cs2O
Таким образом, реакционная способность металлов определяется их электронным строением, положением в периодической системе и способностью образовывать ионы с положительным зарядом при взаимодействии с другими веществами.
Вопрос-ответ

Что такое атомы металлов?
Атомы металлов - это элементы химической системы, которые имеют характерные химические и физические свойства, такие как блеск, электропроводность, пластичность и т.д.
Каковы основные характеристики атомов металлов?
Основные характеристики атомов металлов включают в себя наличие положительного ядра, окруженного облаком электронов, наличие энергетических уровней, на которых располагаются электроны, и наличие таких свойств как металлический блеск, электропроводность, пластичность, теплопроводность и т.д.
Какое влияние оказывают электроны на свойства атомов металлов?
Электроны оказывают влияние на свойства атомов металлов, так как они образуют облако вокруг ядра и определяют химическую и физическую активность атомов. Количество и распределение электронов на энергетических уровнях также влияет на электрические и тепловые свойства металлов.
В чем заключается роль электронов в проводимости электричества металлами?
В проводимости электричества металлами роль играют свободные электроны. В металлах часть электронов, находящихся на внешнем энергетическом уровне, отделяется от атомов и образует собственное облако электронов. Эти свободные электроны могут передвигаться под воздействием электрического поля и создавать электрический ток.
Как атомы металлов взаимодействуют между собой?
Атомы металлов взаимодействуют между собой через свободные электроны. Когда на кристаллическую решетку металла действует напряжение, электроны начинают двигаться в направлении положительного потенциала. Это создает эффект "электронного моря", благодаря которому атомы металлов могут смещаться и обеспечивать пластичность металла.
