Металлы являются одними из самых распространенных элементов в нашей окружающей среде. Они обладают уникальными свойствами, включая высокую электропроводность и теплопроводность. Чтобы понять, как металлы обладают этими свойствами, необходимо изучить, как атомы металлов принимают электроны.
Каждый атом металла состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов, а электронная оболочка содержит электроны. Оболочки атомов металлов могут содержать разное количество электронов, которые располагаются на разных энергетических уровнях.
Атомы металлов стремятся достигнуть наиболее стабильного состояния, заполнив свои электронные оболочки полностью. Для этого атомы металлов образуют связи с другими атомами путем обмена электронами. Обмен электронами позволяет атомам металлов заполнить неполные энергетические уровни и создать более стабильную структуру.
В процессе обмена электронами, атомы металлов могут либо принимать электроны, либо отдавать электроны. Когда атом металла принимает электроны от другого атома, он становится отрицательно заряженным и называется ионом. Принятие электронов позволяет атому металла заполнить свои энергетические уровни и достигнуть стабильного состояния.
Структура атома металла
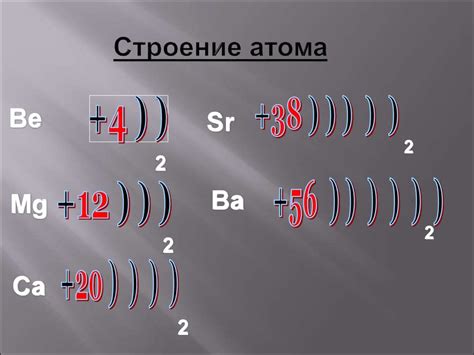
Атомы металлов имеют своеобразную структуру, которая определяет их способность принимать и отдавать электроны. В основе этой структуры лежит ядро атома, состоящее из протонов и нейтронов, а вокруг ядра располагаются электроны.
Электроны находятся на энергетических уровнях или оболочках, которые представляют собой разные энергетические состояния. Ближайшая к ядру оболочка, называемая первой, может вмещать до 2 электронов. Вторая оболочка, находящаяся на большем расстоянии от ядра, может вместить до 8 электронов.
Атом металла стремится достичь стабильности и заполнить свои энергетические оболочки. Для этого он может отдавать или принимать электроны. Когда атом металла теряет электрон, он образует положительно заряженный ион, называемый катионом. Если атом металла принимает электрон, он образует отрицательно заряженный ион, называемый анионом.
Структура атома металла и его способность к обмену электронами определяют его реактивность и химические свойства. Металлы, которые легко отдают электроны, обладают высокой реактивностью и имеют свойства хороших проводников электричества и тепла. В то время как металлы, которые трудно отдают электроны, имеют более низкую реактивность и более устойчивую химическую структуру.
Электроны в атоме

Электроны – это элементарные частицы, обладающие отрицательным электрическим зарядом. Они окружают ядро атома и движутся по определенным энергетическим уровням, которые называются электронными оболочками или орбиталями. Количество электронов в атоме определяет его химические свойства и способность принимать или отдавать электроны.
Электроны в атоме распределены по орбиталям в соответствии с принципом заполнения энергетических уровней. Сначала заполняются орбитали на более низких энергетических уровнях, а затем на более высоких. Этот принцип называется принципом электронного заполнения.
Каждая электронная оболочка может содержать определенное количество электронов. На первой оболочке может находиться не более 2 электронов, на второй – не более 8 электронов, на третьей – не более 8 электронов и т. д. Если оболочка содержит меньшее количество электронов, она может стать стабильной путем принятия или отдачи электронов. Этот процесс называется химической связью.
При взаимодействии атомов металлов с другими атомами, электроны металлов могут быть переданы другим атомам. Металлы имеют свободные электроны, которые могут легко передаваться другим атомам и образовывать ионные или ковалентные связи. Это объясняет их хорошую проводимость электричества и тепла.
Взаимодействие атомов металлов с другими атомами основано на их способности принимать и отдавать электроны. Это определяет химические свойства металлов и их способность образовывать соединения с другими веществами. Также благодаря способности принимать электроны, металлы могут участвовать в химических реакциях и образовывать различные соединения с разными элементами.
Электроны в валентной оболочке
Электроны в валентной оболочке являются самыми внешними электронами атомов металлов. Они определяют химические свойства и реакционную способность металлов. Валентная оболочка может содержать от одного до восьми электронов, в зависимости от атомного номера элемента.
Электроны в валентной оболочке обладают энергией, которая определяет их возможность участвовать в химических реакциях. Они могут быть переданы или приняты другими атомами при образовании химических связей. Электроны в валентной оболочке металлов обычно легко отдаются, что позволяет им образовывать ионные связи и образовывать соединения с другими элементами.
Количество электронов в валентной оболочке может быть определено по периодической таблице элементов. Например, атомы металлов в первом периоде имеют один электрон в валентной оболочке, во втором периоде - два электрона, и так далее. По этой причине, металлы в разных периодах могут иметь разные свойства и способность образовывать соединения с разными элементами.
Процесс принятия электронами
Атомы металлов способны принимать электроны и образовывать ионы с положительным зарядом. Это происходит в процессе реакции атома с атомами других элементов или с молекулами.
Когда атом металла принимает электроны, происходит окислительно-восстановительная реакция. Принятые электроны добавляются в валентную оболочку атома, что изменяет его заряд и делает его ионом. Обычно металлы обладают низкой электроотрицательностью, поэтому они легко принимают электроны и становятся ионами с положительным зарядом.
Процесс принятия электронами влияет на химические и физические свойства металлов. Ионизация металла может вызывать изменения в его отношении к кислороду, водороду и другим атомам, а также в его электропроводности и теплопроводности.
Существует несколько способов, с помощью которых атомы металлов могут принимать электроны. Например, это может быть реакция с веществами, содержащими атомы с высокой электроотрицательностью, такими как кислород или хлор. В таких реакциях атом металла передает электроны атомам других элементов.
Иногда процесс принятия электронами может происходить в условиях высокой температуры или приложенного электрического поля. Это может способствовать разделению заряда и образованию ионов.
Взаимодействие с другими атомами

Атомы металлов проявляют активность взаимодействия с другими атомами, особенно с неметаллическими элементами. Одним из способов взаимодействия является образование химических связей.
Атомы металлов имеют свободные электроны, которые легко могут передаваться другим атомам. При контакте с другими атомами эти свободные электроны осуществляют перенос заряда, что позволяет металлам проявлять электрокондуктивность.
При образовании химической связи с неметаллами, металлы обычно отдают электроны, образуя положительно заряженные ионы. Неметаллы, в свою очередь, принимают эти электроны, образуя отрицательно заряженные ионы.
В результате образуется ионная связь, при которой металлы и неметаллы притягиваются друг к другу благодаря электростатическим силам. Это связь проявляет высокую прочность и обычно характерна для соединений, в которых металлы являются катионами, а неметаллы - анионами.
Также возможно образование координационных связей, при которых атомы металлов позволяют другим атомам или ионам установить связь с собой через общие электроны. При этом атом металла выступает в качестве акцептора электронов, а другой атом или ион - в качестве донора электронов.
Взаимодействие атомов металлов с другими атомами позволяет образовывать различные соединения, такие как соли, координационные соединения и комплексы. Эти соединения играют важную роль в химической промышленности, металлургии и других отраслях науки и техники.
Влияние на свойства металлов

Свойства металлов зависят от их атомных структур и способности принимать и передавать электроны. Металлы отличаются от других типов веществ своей проводимостью электричества и тепла, высокой пластичностью и прочностью.
Одним из факторов, влияющих на свойства металлов, является их микроструктура. Металлы имеют кристаллическую структуру, состоящую из регулярно упакованных атомов. Кристаллическая решетка определяет свойства металла, такие как твердость, пластичность и температуры плавления и кипения. Например, металлы с более прочной кристаллической решеткой обычно имеют большую твердость и температуру плавления.
Также, свойства металлов зависят от их электронной структуры. Металлы имеют относительно низкую электроотрицательность, что означает, что их атомы имеют меньшую способность принимать электроны. Это позволяет атомам металлов образовывать межатомные связи и образовывать кристаллы с электронами, свободно движущимися в них. Именно эти свободные электроны делают металлы хорошими проводниками электричества и тепла.
Кроме того, влияние на свойства металлов оказывают примеси и легирующие элементы. Примеси могут влиять на проводимость, магнитные свойства и коррозионную стойкость металлов. Легирующие элементы могут значительно улучшить механические свойства металлов, такие как твердость и прочность.
Роль атомов металлов в различных процессах

1. Каталитические реакции: Атомы металлов играют важную роль в каталитических реакциях, ускоряя их протекание и увеличивая их эффективность. Они способны принимать электроны и переходить между различными степенями окисления, что позволяет им активно взаимодействовать с реагентами и способствовать образованию продуктов. Например, палладий и платина используются в каталитических конвертерах автомобилей для очистки отзывных газов, а никель и железо – в гидрогенизаторах для процессов гидрирования.
2. Роль в электродных процессах: Атомы металлов принимают активное участие в электродных процессах, таких как окислительно-восстановительные реакции и электролиз. При подключении внешнего источника энергии между электродами происходит перенос электронов между атомами металла. Например, в гальванических элементах атомы цинка окисляются на аноде, передавая электроны во внешнюю цепь, а атомы меди восстанавливаются на катоде, принимая электроны из внешней цепи.
3. Укрепление металлических материалов: Атомы металлов играют важную роль в процессе укрепления металлических материалов. Они способны принимать дополнительные электроны и образовывать межатомные связи, что повышает прочность и твердость материала. Например, в процессе закалки стальной заготовки атомы железа принимают дополнительные электроны, что способствует образованию межатомных связей и повышению твердости стали.
4. Роль в оптических процессах: Атомы металлов также играют важную роль в оптических процессах, связанных с взаимодействием света с металлами. Они способны поглощать и рассеивать свет, изменять его цвет и интенсивность. Благодаря этим свойствам атомы металлов находят широкое применение в различных областях, таких как оптические покрытия, солнечные элементы и лазерные технологии.
Вопрос-ответ

Какие свойства имеют атомы металлов?
Атомы металлов имеют особые свойства, такие как хорошая электропроводность, металлический блеск и способность образовывать кристаллическую решетку.
Как атомы металлов принимают электроны?
Атомы металлов принимают электроны путем перехода электронов из внешней оболочки одного атома на внешнюю оболочку соседнего атома. Это происходит благодаря наличию свободных электронов в металле, которые легко передвигаются между атомами.
