Металлы - одна из самых широко распространенных групп веществ в нашем мире. Они обладают множеством уникальных свойств, которые делают их незаменимыми в различных отраслях промышленности и научных исследованиях. Одно из ключевых свойств металлов - их способность принимать, но не отдавать электроны.
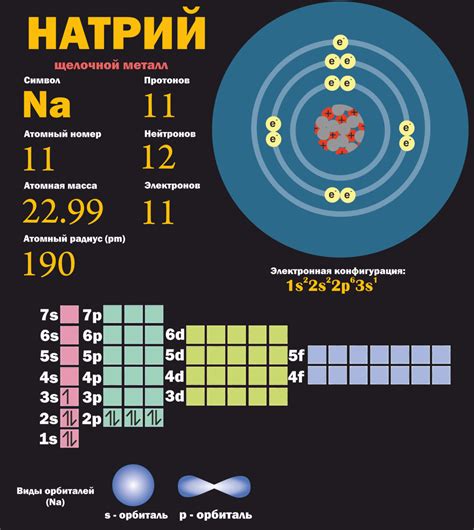
Электроны - основные носители электрического заряда в атомах. Они обращаются между атомами металла, создавая электронное облако, которое отвечает за особенности металлического связывания. У металлов сравнительно низкая электроотрицательность, что означает, что они имеют тенденцию принимать электроны от других элементов, но редко отдавать их.
Эффект принятия электронов является основой многих свойств металлов. Он делает их хорошими проводниками электричества и тепла, а также дает способность к деформации и образованию сплавов. Кристаллическая решетка металлов обладает высокой подвижностью электронов, что обуславливает их высокую проводимость. Кроме того, металлы часто способны вступать в химические реакции, но только в роли приемника электронов.
Принятие электронов металлами происходит благодаря их электронной структуре. У атомов металлов обычно мало электронов в валентной оболочке, поэтому они стремятся заполнить валентные электронные уровни, принимая электроны от других элементов. Этот процесс может привести к образованию ионов, которые заряжены отрицательно и представляют собой внешнюю обертку металлов.
Металлические атомы: особенности приема и передачи электронов
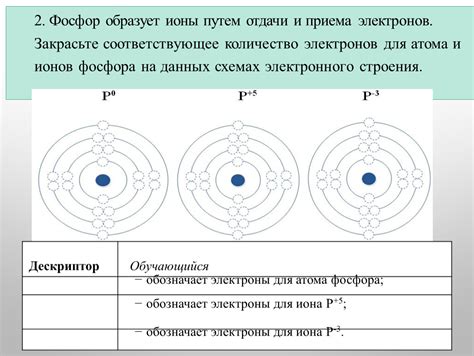
Металлические атомы обладают особыми свойствами, связанными с приемом и передачей электронов. Их электронная структура отличается от других элементов и обеспечивает уникальную электронную проводимость металлов.
Основной характеристикой металлических атомов является существование свободных электронов в валентной оболочке. Эти электроны могут свободно перемещаться по кристаллической решетке металла, создавая электронное облако. Такое свободное движение электронов обусловливает высокую электропроводность металлов.
Металлические атомы имеют малую электроотрицательность, что обусловлено размером и структурой их электронных облаков. В связи с этим, металлы обладают способностью легко принимать электроны от других атомов. Это происходит при образовании металлических связей и является основой для создания химических соединений с неметаллическими элементами.
Однако, особым свойством металлических атомов является то, что они обычно не отдают свои электроны другим атомам. Это связано с особым распределением электронной плотности и энергией валентных электронов металла. Поэтому металлы редко образуют ионные соединения и не участвуют в реакциях передачи электронов, характерных для неметаллов.
Таким образом, металлические атомы обладают особенностями приема и передачи электронов, связанными с наличием свободных электронов и невысокой электроотрицательностью. Эти особенности определяют их уникальные физические и химические свойства, делающие металлы важными и широко используемыми материалами в различных отраслях промышленности и науки.
Металлическая структура и принцип работы
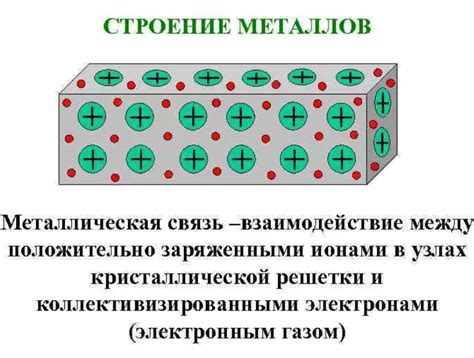
Металлы отличаются своей особой структурой, которая отличает их от других типов материалов. Основу металлической структуры составляют кристаллические решетки, в которых атомы размещаются регулярно и образуют сетку. Кристаллическая структура позволяет металлам иметь высокую прочность и эластичность, а также обладать свойствами, характерными для металлов, такими как хорошая теплопроводность и электропроводность.
Принцип работы металлов основан на способности металлических атомов только принимать, но не отдавать электроны. В металлической структуре, электроны свободно перемещаются по сетке и формируют так называемое море электронов. Эти свободные электроны обладают высокой подвижностью и могут передаваться от одного атома к другому. Благодаря этому, металлы обладают хорошей электропроводностью.
Другим важным свойством металлической структуры является способность к пластичности и деформации. При действии механической нагрузки, атомы металла передвигаются, сохраняя общую кристаллическую структуру. Это позволяет металлам быть легкими в обработке и готовыми к формированию различных изделий.
Таким образом, металлическая структура и принцип работы определяют основные характеристики металлов и являются основой для их широкого применения в различных отраслях промышленности и технологий.
Эффект ионизации и влияние на свойства вещества
Эффект ионизации является одной из основных характеристик металлических атомов. Он определяет способность металлов принимать ионы и удерживать их в своей структуре. Металлические атомы обладают низкой электроотрицательностью, что позволяет им легко отдавать электроны и образовывать положительно заряженные ионы.
Эффект ионизации сильно влияет на свойства вещества, обуславливая такие явления, как теплопроводность, электропроводность и пластичность металлов. За счет свободно движущихся электронов в металлической решетке, металлы обладают высокой электропроводностью. Электроны могут передвигаться по металлу, образуя электрический ток.
Также эффект ионизации влияет на теплопроводность металлов. В металлической решетке свободные электроны передают тепло от одного атома к другому, обеспечивая эффективную передачу тепла через металл. Благодаря этому свойству, металлы широко применяются в технике и строительстве для изготовления теплопроводных элементов и конструкций.
Кроме того, эффект ионизации определяет пластичность металлов. Металлическая решетка, состоящая из положительно заряженных ионов и мобильных электронов, позволяет атомам металла легко передвигаться относительно друг друга под действием внешней силы. Это свойство делает металлы удобными для обработки и формования, что позволяет создавать сложные детали и изделия из металла.
Механизмы приема электронов металлическими атомами
Металлические атомы, благодаря своей особой структуре и соединениям, способны принимать электроны без отдачи. Этот процесс является одним из ключевых механизмов, обеспечивающих электропроводность металлов.
Принятие электронов металлическими атомами происходит за счет особенностей их электронной структуры. У металлических атомов внешний энергетический уровень, называемый фермиевским уровнем, частично заполнен электронами. Под действием внешних электронов или электромагнитного излучения происходит возмущение на фермиевском уровне, и возникает возможность приема новых электронов.
Металлические атомы принимают электроны в свою довольно свободную электронную оболочку, которая характеризуется наличием "моря" незанятых энергетических состояний. При приеме электронов, уже находящиеся в свободных состояниях, сдвигаются в более низкие энергетические уровни, образуя эффект электронных полей, которые способствуют сохранению новых электронов в области приема.
Кроме того, металлические атомы могут принимать электроны благодаря образованию связей с другими атомами или молекулами. При взаимодействии с атомами других элементов металлические атомы формируют комплексы, в которых они могут удерживать дополнительные электроны. Это объясняет, почему металлы могут образовывать стабильные ионные соединения, где они выступают в роли доноров электронов.
Возможность передачи электронов в металлах

Металлы - уникальные материалы, которые обладают особыми свойствами. Одним из таких свойств является возможность передачи электронов внутри подвижной электронной оболочки металлических атомов.
Металлы являются хорошими проводниками электричества благодаря этому свойству. Внутри металла существует свободное движение электронов, которые способны передвигаться от одного атома к другому.
Электроны в металлах образуют так называемое "море электронов". Они не принадлежат конкретным атомам, а свободно перемещаются по материалу. Это объясняет способность металлов проводить электрический ток - электроны могут передаваться от атома к атому вдоль металлической структуры.
Интересно отметить, что металлы способны только принимать электроны, но не отдавать их. Это связано с особенностями структуры металлической оболочки атомов. При контакте с другими материалами, металлические атомы переносят электроны на атомы другого вещества, что создает разность потенциалов и вызывает электрический ток.
Практическое применение металлических атомов в различных отраслях
Металлические атомы играют важную роль во многих отраслях нашей жизни благодаря своим уникальным свойствам и способности принимать, но не отдавать электроны. Вот некоторые способы применения металлических атомов:
- Электроника: Металлические атомы используются в производстве электронных компонентов, таких как провода, контакты и электрические соединения. Их высокая электропроводимость позволяет эффективно передавать электрический ток и обеспечивать работу различных устройств.
- Металлургия: Металлические атомы применяются в процессе обработки и производства металлических материалов, таких как сталь или алюминий. Они способны создавать сильные связи между атомами, что придает материалам прочность и устойчивость к деформации.
- Химическая промышленность: Металлические атомы используются в качестве катализаторов при проведении реакций, ускоряя химические процессы и увеличивая их эффективность. Они также могут быть использованы в производстве различных химических соединений и продуктов.
- Автомобильная промышленность: Металлические атомы применяются для создания различных компонентов автомобилей, включая кузов, двигатель и электрическую систему. Их прочность и стабильность позволяют создавать надежные и долговечные автодетали.
Кроме того, металлические атомы находят применение в сфере строительства, энергетики, медицины и других отраслях. Их уникальные свойства делают их незаменимыми в процессе проектирования и производства различных изделий и материалов. Понимание и управление свойствами металлических атомов играет важную роль в развитии новых технологий и повышении эффективности существующих процессов.
Вопрос-ответ

Почему металлические атомы не отдают электроны?
Металлические атомы обладают особой структурой и свойствами, которые не позволяют им отдавать электроны. Это связано с наличием свободных электронов, которые могут свободно двигаться в металле и создавать электронное облако вокруг атомов.
Какие свойства металлов обусловливают их способность к принятию, но не отдаче электронов?
Свойства металлов, такие как низкая электроотрицательность, большой радиус атомов и наличие свободных электронов, обуславливают их способность принимать, но не отдавать электроны. Эти свойства позволяют металлам образовывать кристаллическую решетку и обладать хорошей проводимостью электричества и тепла.
Какие металлы обладают способностью принимать электроны, но не отдавать?
Почти все металлы обладают способностью принимать, но не отдавать электроны. Некоторые примеры таких металлов: железо, алюминий, медь, свинец, никель. Это связано с особенностями их структуры и электронной конфигурации.
Какие факторы влияют на способность металлических атомов принимать электроны, но не отдавать?
Способность металлических атомов принимать, но не отдавать электроны зависит от нескольких факторов. Важными факторами являются: электроотрицательность и размер атомов, наличие свободных электронов, структура кристаллической решетки и особенности электронной конфигурации.
Как способность металлических атомов принимать электроны, но не отдавать, связана с их структурой?
Структура металлов включает в себя кристаллическую решетку, в которой атомы металла тесно упакованы и образуют "море" свободных электронов. Это "море" электронов позволяет металлам принимать электроны, но не отдавать их, так как они свободно двигаются по кристаллической решетке.
