Металлы являются важным классом элементов периодической системы, которые проявляют различные свойства взаимодействия с окружающей средой. В основе их химических свойств лежит способность атомов металлов отдавать и принимать электроны. Это взаимодействие определяет такие важные свойства металлов, как электропроводность, термическое расширение, пластичность и многие другие.
Взаимодействие атомов металлов основано на их электронной структуре. Атомы металлов имеют небольшую энергию ионизации, поэтому они легко отдают свои электроны, передавая их другим атомам или молекулам. Это явление называется окислением и является одной из основных реакций, происходящих с металлами.
При окислении атом металла становится положительно заряженным и становится ионом. Отдавая свои электроны, металл приобретает более стабильную электронную конфигурацию, соответствующую более низкой энергии. Получивший электроны атом или молекула становятся отрицательно заряженными ионами.
Металлы также могут принимать электроны, образуя отрицательные ионы. Это происходит в результате взаимодействия с атомами других элементов, которые могут передать свои электроны металлу. Это явление называется восстановлением и играет важную роль в различных химических реакциях, таких как редокс-реакции.
Роль металлов в химических процессах

Металлы играют важную роль в химических процессах и широко используются в различных отраслях промышленности и научных исследованиях. Они имеют уникальные свойства, которые позволяют им участвовать в разнообразных реакциях и взаимодействиях.
Одним из основных свойств металлов является их способность отдавать и принимать электроны. Это основа для многих химических реакций, таких как окислительно-восстановительные процессы и электролиз.
Металлы могут образовывать ионы положительного заряда, которые обладают высокой электропроводностью. Именно благодаря этому свойству они могут быть использованы в производстве электроники, электрических проводов и различных устройств, которые требуют передачи электрического тока.
Взаимодействие металлов с другими веществами может приводить к образованию химических соединений и сложных структур. Металлы могут выступать в качестве катализаторов, активируя различные химические реакции и повышая их скорость. Поэтому они широко применяются в каталитической химии и промышленности.
Кроме того, металлы обладают высокой теплопроводностью и могут присутствовать в составе главных компонентов различных сплавов. Это делает их важными в производстве металлургических материалов и строительных конструкций.
Основные свойства металлических элементов
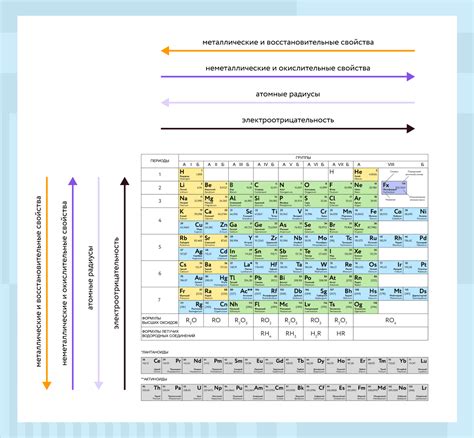
Металлические элементы обладают рядом уникальных свойств, которые делают их основными строительными блоками материи и позволяют им выполнять различные функции в природе и промышленности.
Проводимость электричества: Металлы хорошо проводят электрический ток благодаря свободно движущимся электронам в их структуре. Это позволяет использовать металлы для создания электрических проводов и других электрических устройств.
Проводимость тепла: Металлы также обладают высокой теплопроводностью, что означает, что они способны эффективно передавать тепло. Это свойство делает металлы полезными для создания кухонной посуды, обогревательных элементов и других теплопроводящих устройств.
Пластичность: Металлы обладают способностью к объемной деформации без разрушения. Это позволяет им легко подвергаться обработке и формированию в различные изделия, такие как прутки, проволока, листы и т.д.
Прочность: Металлы также отличаются высокой прочностью и устойчивостью к механическим нагрузкам. Они могут выдерживать большое количество напряжения без разрушения, что делает их важными конструкционными материалами, используемыми в строительстве и машиностроении.
Металлический блеск: Многие металлы обладают характерным блеском. Это связано с их способностью отражать свет. Блеск металлов делает их привлекательными для использования в ювелирных изделиях и других декоративных целях.
Вариативность химических свойств: Металлы образуют широкий диапазон соединений с другими элементами, обладающими различными химическими свойствами. Это делает их полезными для различных химических и промышленных процессов, включая производство лекарств, сельскохозяйственных удобрений и катализаторов.
Взаимодействие металлов с внешними электронами
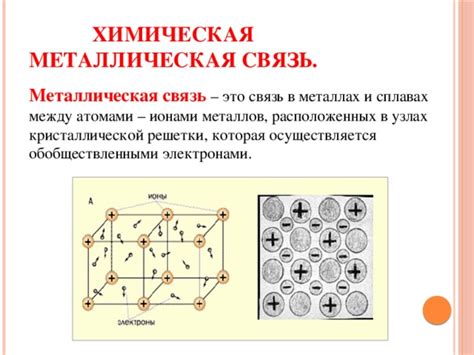
Атомы металлов, такие как железо, алюминий, медь и многие другие, имеют особые свойства благодаря своей электронной структуре. Они обладают заполненными энергетическими уровнями с внутренними электронами и неполностью заполненными внешними энергетическими уровнями.
Взаимодействие металлов с внешними электронами играет ключевую роль в реакциях металлов с другими веществами. Внешние электроны могут быть приняты или отданы атомом металла, что ведет к образованию ионов или обмену электронами с другими атомами.
Процесс отдачи внешних электронов атомом металла называется окислением, а процесс приема внешних электронов - восстановлением. Эти процессы могут происходить одновременно, образуя оксидационно-восстановительные реакции.
Металлы способны отдавать внешние электроны благодаря своей электронной структуре. Внешние электроны имеют более высокую энергию, чем электроны внутренних энергетических уровней, поэтому они могут легко передаваться другим атомам или группам атомов.
Взаимодействие металлов с внешними электронами имеет важное практическое значение. Металлические материалы используются в различных отраслях промышленности, в технике и в повседневной жизни. Понимание особенностей взаимодействия металлов с внешними электронами помогает улучшить свойства и эффективность металлических материалов и создать новые материалы с желаемыми характеристиками.
Вопрос-ответ

Чем отличается взаимодействие атомов металлов при отдаче и приеме внешних электронов?
Взаимодействие атомов металлов при отдаче и приеме внешних электронов отличается в зависимости от типа реакции. При отдаче электронов атом металла теряет один или несколько электронов из своей внешней оболочки и становится положительно заряженным ионом. При приеме электронов атом металла получает дополнительные электроны и становится отрицательно заряженным ионом. В обоих случаях изменяется заряд атома металла и его электронная конфигурация, что приводит к изменению его химических свойств и способности взаимодействовать с другими атомами.
Какие факторы влияют на способность атомов металлов отдавать или принимать электроны?
Способность атомов металлов отдавать или принимать электроны зависит от нескольких факторов, в том числе от номера атома в периодической системе, его радиуса и энергии ионизации, а также от условий окружения. Например, атомы металлов с малым радиусом и высокой энергией ионизации обычно отдают электроны, тогда как атомы металлов с большим радиусом и низкой энергией ионизации предпочитают принимать электроны. Окружающая среда также может влиять на процесс отдачи или приема электронов, создавая электронную плотность вокруг атомов металлов или влияя на их электрическое поле.
Как взаимодействие атомов металлов при отдаче и приеме электронов может быть использовано в химических реакциях и производстве?
Взаимодействие атомов металлов при отдаче и приеме электронов является основой для многих химических реакций и процессов в промышленности. Например, при производстве металлов из их руд и минералов происходит взаимодействие атомов металлов с различными реагентами, что позволяет получить чистые металлические материалы. Также взаимодействие атомов металлов при отдаче и приеме электронов используется в электрохимических процессах, таких как электролиз, которые позволяют получать различные химические соединения и проводить электродные реакции.
