Химические связи – это взаимодействие между атомами, когда они образуют молекулы или кристаллическую решетку. Одно из основных свойств металлов – их способность образовывать металлические связи. Металлические связи представляют собой электронное облако, которое держит вместе положительно заряженные ядра металлических атомов и свободные электроны.
Но как обстоит дело с химическими связями между атомами самого металла? Для большинства металлов типичной является металлическая связь, однако некоторые металлы, особенно находящиеся в высоких группах периодической системы, способны образовывать и другие типы связей.
Интересен тот факт, что металлы из группы 1 и 2 (например, литий, натрий, калий, магний и кальций) имеют самые низкие электроотрицательности и считаются наиболее активными металлами. Они легко образуют ионные связи с другими атомами, например, с кислородом или хлором. В таких соединениях атомы металла передают свои электроны атомам других элементов, образуя положительно заряженные ионы.
Таким образом, химические связи между атомами металлов могут быть различными в зависимости от их положения в периодической системе. В большинстве случаев металлы образуют металлические связи, но некоторые металлы могут также образовывать ионные связи с другими элементами. Это делает металлы уникальными и весьма важными для химической промышленности и других областей науки и техники.
Атомы металлов и химические связи: правда или миф?

Химические связи между атомами металлов являются фундаментальным понятием в химии. Они действительно существуют и образуются в результате взаимодействия электронов во внешней оболочке атомов. Такие связи называются металлическими.
Металлы, такие как железо, алюминий или медь, обладают особыми свойствами, которые определяются их химическими связями. Атомы металлов обычно имеют мало электронов во внешней оболочке и легко отдают их другим атомам. В результате, образуется общая "облако" электронов, которые связывают все атомы металла в кристаллическую структуру.
Металлические связи проявляются во множестве свойств и поведении металлов. Они обладают высокой теплопроводностью, электропроводностью и пластичностью. Благодаря своей структуре, атомы металлов могут переходить из одного положения в другое без разрушения связей, что позволяет им легко подвергаться формированию различных конструкций и обрабатываться в различных способах.
Таким образом, химические связи между атомами металлов - не миф, а действительность. Именно они придают металлам их особые физические и химические свойства, делая их неотъемлемой частью нашей повседневной жизни.
Общая информация об атомах металлов

Атомы металлов - основные строительные блоки металлических материалов. Они играют важную роль в формировании и химической связи между атомами в металлической решетке.
Атомы металлов обладают низкой электроотрицательностью, что позволяет им образовывать ионные и металлические связи. Ионные связи образуются при переходе электронов от металлического атома на атом неметалла, а металлические связи формируются благодаря общей электронной оболочке, которая образуется при наличии свободных электронов.
Атомы металлов обладают высокой проводимостью электричества и тепла из-за свободного движения электронов. Они также имеют способность к деформации, благодаря чему металлы могут быть прочными и гибкими одновременно.
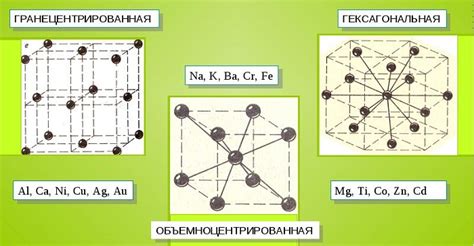
Атомы металлов обычно образуют кристаллические структуры, которые обеспечивают им прочность и устойчивость. Такие структуры могут быть различных типов, например, гранцентрированные, простейшие кубические и сложные центрированные.
Общая информация об атомах металлов позволяет понять основные свойства металлических материалов и их поведение при формировании химических связей.
Химические связи между атомами металлов
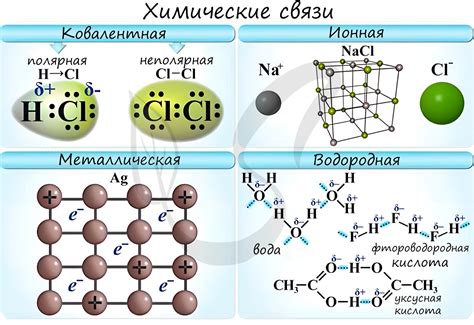
Металлы - это элементы, которые обладают свойством образовывать химические связи между своими атомами. Такие связи называются металлическими.
Металлические связи возникают благодаря особенностям электронной структуры атомов металлов. Внешний электронный уровень у металлов содержит обычно небольшое количество электронов, что делает их склонными к образованию положительных ионов. В решетке металла положительно заряженные ионы служат ядрами, а полностью делимые в пространстве электроны находятся между ними.
Электроны, не привязанные к конкретным атомам, называются электронами свободными. Они не пренадлежат какому-либо атому и могут свободно двигаться по всей решетке металла. Благодаря этому свойству электроны способны передавать энергию и электрический ток через металл.
Металлические связи имеют ряд особенностей. Они являются очень прочными и во многих случаях обладают высокой теплопроводностью и электропроводностью. Также металлические связи обуславливают специфические механические свойства металлов, такие как пластичность и деформируемость.
Аргументы за и против формирования химических связей у атомов металлов
Возможность образования химических связей у атомов металлов является основополагающим принципом химии. Этот процесс имеет свои аргументы за и против, которые следует рассмотреть.
Аргументы за формирования химических связей у атомов металлов:
1. Возможность образования металлической связи. Вещества, состоящие из атомов металла, могут образовывать металлическую связь, при которой положительно заряженные ионы металла окружены "облаком" свободных электронов. Это обеспечивает хорошую электропроводность, теплопроводность и пластичность металлов.
2. Образование ионных связей. Атомы металлов могут образовывать ионные связи с атомами неметаллов. В результате таких связей образуются кристаллические решетки, которые обладают устойчивостью и могут образовывать кристаллы различных веществ.
3. Возможность образования сложных соединений. Металлы способны образовывать сложные соединения с другими элементами, что позволяет создавать различные материалы с определенными свойствами. Например, железо может образовывать оксиды, которые используются в производстве стали.
Аргументы против формирования химических связей у атомов металлов:
1. Высокая реакционность. Атомы металлов могут быть очень реакционными и создавать опасные химические соединения. Некоторые металлы могут реагировать с водой или с кислородом воздуха, что может привести к возгоранию или образованию токсических веществ.
2. Токсичность некоторых металлов. Некоторые металлы, например, свинец или ртуть, могут быть токсичными для организма человека. Это может вызывать различные заболевания и отравления.
3. Влияние на окружающую среду. Процессы формирования химических связей у атомов металлов могут приводить к загрязнению окружающей среды. Это может быть связано с выбросами вредных веществ в атмосферу, отходами производства или загрязнением водных ресурсов.
В целом, формирование химических связей у атомов металлов имеет свои преимущества и недостатки, которые следует учитывать при применении и использовании металлических соединений.
Выводы о возможности образования химических связей у атомов металлов

Атомы металлов обладают способностью образования химических связей, что является одной из важных характеристик данных элементов. В химии металлы классифицируются как элементы, обладающие способностью отдавать электроны и образовывать ионные и металлические связи.
Одной из основных причин возможности образования химических связей у атомов металлов является их электронная структура. Атомы металлов имеют относительно малое количество валентных электронов, что способствует их легкому отдаче другими атомами, в результате чего образуются ионные связи.
Ионные связи между атомами металлов и неметаллов особенно характерны для переходных и блоков s и p, в то время как у блока d и f прослеживается склонность к образованию металлических связей. Металлические связи формируются благодаря наличию свободных электронов, которые могут свободно перемещаться между атомами металла, создавая таким образом сильные связи.
Образование химических связей у атомов металлов играет важную роль во многих процессах и явлениях, таких как проводимость электрического тока, термообработка, создание сплавов и другие. Понимание и изучение свойств атомов металлов и их способности образовывать химические связи позволяет разрабатывать новые материалы и применять их в различных областях науки и техники.
Вопрос-ответ

Атомы металлов образуют химические связи верно или неверно?
Верно. Атомы металлов образуют химические связи между собой и другими элементами. Они могут образовывать ионные связи, ковалентные связи и металлические связи.
Какие типы химических связей образуют атомы металлов?
Атомы металлов могут образовывать ионные связи, ковалентные связи и металлические связи. В ионных связях между атомами металлов и неметаллов происходит передача электронов, в ковалентных связях электроны общуются попарно, а в металлических связях электроны образуют облако, свободное перемещаться по кристаллической решетке.
