Металлы являются одной из основных групп элементов в периодической системе. Они обладают рядом характеристик, таких как блеск, теплопроводность и электропроводность. Но что делает их такими специфичными и почему они формируют особый тип химической связи?
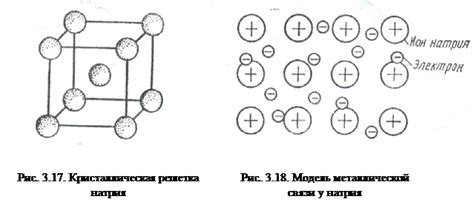
Наиболее важным аспектом металлов является их атомная структура. Атомы металлов обладают большим количеством свободных электронов на внешнем энергетическом уровне. Эти электроны, называемые валентными электронами, способны свободно перемещаться внутри металлической сетки. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью, а также могут быть легко обработаны и подвергнуты формированию различных структур.
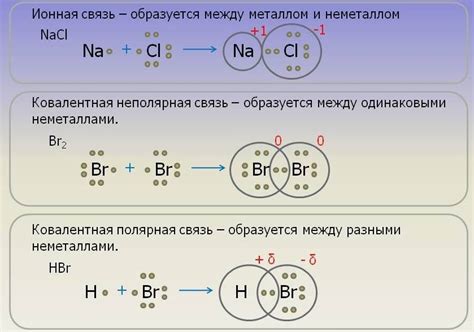
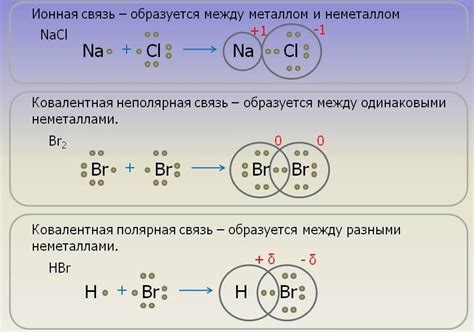
Ионные связи возникают между атомами разных элементов, в которых происходит полная передача или приобретение электронов. Классическим примером ионной связи является взаимодействие между металлом и неметаллом. Металлический атом отдает один или несколько своих валентных электронов, превращаясь в положительно заряженный ион, называемый катионом. Неметалл, в свою очередь, получает эти электроны, превращаясь в отрицательно заряженный ион, называемый анионом.
Полученные катионы и анионы образуют решетку, в которой положительные ионы притягиваются к отрицательным ионам с помощью электростатических сил. Этот тип связи обеспечивает высокую прочность и устойчивость соединений, образованных металлами и неметаллами, и объясняет многие их свойства, включая точку плавления и кипения, твердость и солюбильность.
Свойства и структура атомов металлов

Атомы металлов обладают рядом уникальных свойств и особенностей, которые определяют их поведение и способность образовывать ионные связи.
Первое из этих свойств - наличие довольно большого числа электронов во внешней оболочке. В результате этого, атомы металлов обладают низкой электроотрицательностью и склонностью отдавать электроны. Это также связано с тем, что атомы металлов имеют малое количество энергетических уровней и, следовательно, энергия ионизации для них является относительно низкой.
Также стоит отметить, что атомы металлов имеют групповую или кристаллическую структуру. Они образуют кристаллическую решетку, в которой атомы располагаются в регулярном порядке и связаны друг с другом с помощью металлических связей. Это позволяет металлам обладать высокой проводимостью тепла и электричества, а также хорошей пластичностью и прочностью.
Кроме того, атомы металлов имеют большой размер и атомный радиус. Это обусловлено тем, что металлы имеют большое количество электронов и протонов в ядре, что приводит к увеличению размера атома. Большой атомный радиус также способствует образованию ионной связи, так как позволяет электронам передвигаться между атомами металла более свободно.
Ионные связи в металлах и их роль
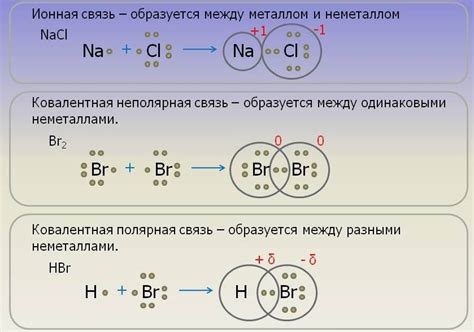
Металлы — это элементы, которые обладают высокой электропроводностью, благодаря своей способности образовывать ионные связи. Ионные связи в металлах играют важную роль в их структуре и свойствах.
Ионная связь в металлах возникает между металлическими катионами и свободными электронами. Металлические катионы, такие как ионы натрия или калия, образуют положительно заряженные ядра, вокруг которых свободно движутся электроны. Эта структура позволяет металлам иметь высокую теплопроводность и электропроводность.
Роль ионных связей в металлах не ограничивается только их электропроводимостью. Ионные связи также отвечают за другие важные свойства металлов, такие как их твердость, пластичность и точка плавления. Особенностью ионных связей в металлах является их высокая степень упорядоченности, обеспечивающая прочность и устойчивость металлических структур.
Кроме того, ионные связи в металлах определяют их способность образовани
Вопрос-ответ

Что такое атомы металлов?
Атомы металлов - это атомы элементов, которые образуют металлы. Они характеризуются наличием свободных электронов в своей внешней электронной оболочке, что делает их хорошими проводниками электричества и тепла.
Какая структура у атомов металлов?
Атомы металлов имеют кристаллическую структуру. Они образуют решетки, в которых атомы расположены в регулярных позициях. Это обеспечивает металлам их основные свойства - прочность, тугоплавкость и деформируемость.
Как происходит образование ионных связей?
Ионные связи образуются между атомами с разными зарядами. Когда атомы металлов отдают свои электроны атомам неметаллов, они становятся положительно заряженными ионами (катионами), а атомы неметаллов - отрицательно заряженными ионами (анионами). Эти ионы притягиваются друг к другу и образуют ионные связи.
Какие свойства имеют металлы из-за ионных связей?
Металлы, образованные ионными связями, обладают такими свойствами, как высокая теплопроводность, электропроводность и тугоплавкость. Ионные связи обеспечивают прочность и стабильность металлической решетки, что делает металлы хорошими материалами для строительства и производства различных изделий.