Металлическая связь является одной из самых распространенных форм химической связи веществ. Она обладает уникальными свойствами, которые позволяют металлам быть одними из основных строительных блоков нашего мира. Процесс образования металлической связи связан с поведением атомов металла и их электронов.
Основной причиной образования металлической связи является способность атомов металла образовывать положительно заряженные ионы, или катионы. В результате этого процесса, атомы металла становятся электроноакцепторами, то есть они готовы принять электроны от другого атома. Этот процесс позволяет атомам металла образовать положительные заряды и стать источниками электронов для других атомов.
Однако, катионы атомов металла самостоятельно не могут перемещаться и участвовать в образовании связей. Именно здесь на сцену выходят электроны. В металлах, электроны могут свободно перемещаться между атомами. Они образуют так называемую "электронную оболочку", и их поведение становится коллективным. Это является ключевым элементом образования металлической связи.
В результате перемещения электронов между атомами металла, образуется некий "облако" электронов, которое окружает положительно заряженные катионы. Это облако электронов, или электронное облако, обладает особыми свойствами. К примеру, оно способно проводить электрический ток, что является одним из ключевых свойств металлов. Также, электроны в этом облаке обладают свойством определенного подвижности, что позволяет металлам быть хорошими проводниками тепла и электричества.
Металлическая связь - это особая форма химической связи, которая образуется благодаря взаимодействию атомов металла и их электронов. Она является основой множества уникальных свойств металлов, таких как проводимость тока, высокая теплопроводность и многие другие.
Металлическая связь: как происходит образование связи между атомами металлов

Металлическая связь – это особый тип химической связи, который образуется между атомами металлов. В процессе образования металлической связи перенос электронов играет ключевую роль.
В металлах, в отличие от других типов веществ, электроны внешней электронной оболочки свободно движутся по кристаллической решетке. Они не привязаны к определенным атомам и могут свободно перемещаться по всему металлу. В результате образуется общая «облако» электронов, которое окружает положительно заряженные ядра атомов металла.
Свободные электроны в металлической связи отвечают за множество характеристик и свойств металлов. Они обладают отличной проводимостью электричества и тепла, а также способностью формировать ковку и плавкость. Металлы обычно обладают высокой плотностью и хорошими физическими свойствами, благодаря металлической связи.
Металлическая связь в металлах образуется благодаря сильным притяжениям между положительно заряженными ядрами и свободными электронами. Она является одной из наиболее прочных и стабильных связей в природе. Благодаря этой связи, металлы обладают высокой стойкостью к механическим и химическим воздействиям и способны выдерживать большие нагрузки и температуры.
Формирование электронных облаков
Металлическая связь возникает благодаря специфическому взаимодействию между атомами металла. Электроны в нижних энергетических уровнях атомов металлов образуют облако свободных электронов, которые выходят за пределы отдельных атомных ядер и становятся доступными для общего использования. Эти свободные электроны окружают положительно заряженные атомные ядра, создавая электронное облако.
Формирование электронных облаков связано с особенностями строения металлической решетки. Атомы металла располагаются близко друг к другу в кристаллической решетке и образуют периодическую структуру. В этой структуре каждый атом металла имеет несколько соседних атомов, с которыми он образует сильные связи. Такая укладка атомов позволяет электронам передвигаться свободно внутри металла и образовывать электронные облака.
Образование электронных облаков в металлах обусловлено делимостью электронов. Электроны в металлах не принадлежат отдельным атомам, а двигаются по всей металлической решетке. Они могут быть перераспределены среди атомов металла благодаря отсутствию жесткой границы между отдельными атомами. В результате образуется электронное облако, которое обеспечивает электрическую проводимость и другие свойства металлической связи.
Особенности электронной структуры металлов

Электронная структура металлов обладает рядом особенностей, которые делают их отличными от других типов веществ. В металлах, электроны находятся в общем энергетическом состоянии, образуя так называемое "море электронов". Это означает, что электроны свободно перемещаются по кристаллической решетке металла.
Электроны в металлах могут быть также описаны моделью свободных электронов, в которой они рассматриваются как независимые частицы, свободно движущиеся в потенциальном поле ядер металла. Этот подход объясняет высокую электропроводность и теплопроводность металлов, так как свободные электроны способны передвигаться без значительных препятствий.
Одна из примечательных особенностей электронной структуры металлов - наличие у них валентных электронов, которые могут участвовать в химических реакциях. Благодаря этому, металлы могут образовывать соединения с другими веществами и проявлять свои химические свойства.
Взаимодействие электронов и ядер атомов металлов
Металлическая связь - особый тип химической связи, характерный для металлов. Ее образование основано на взаимодействии электронов и ядер атомов металлов.
В металлической связи электроны внешних оболочек атомов металлов не привязаны к конкретным атомам, а свободно перемещаются вокруг положительно заряженных ядер. Это создает специфическую структуру, обуславливающую множество уникальных свойств металлов.
Взаимодействие электронов и ядер атомов металлов обеспечивает высокую проводимость электрического тока в металлах. Когда внешняя сила приводит к движению электронов, они передают энергию ядрам, вызывая колебания решетки металла и нагрев его. Это объясняет высокую теплопроводность металлов.
Под воздействием электрического поля электроны свободно перемещаются, создавая ток. Также взаимодействие электронов и ядер определяет магнитные свойства металлов. Магнитная способность металла определяется количеством свободных электронов и их спиновым моментом.
Связь в кристаллической решётке металлов
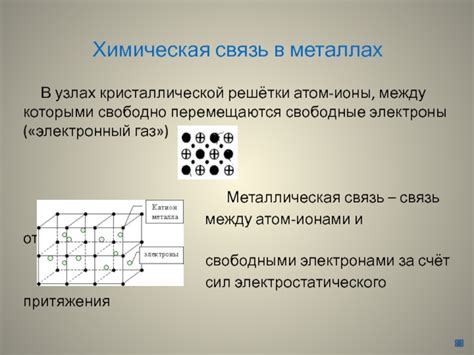
Металлы обладают особым типом химической связи - металлической связью. Она характеризуется тем, что в кристаллической решётке металла атомы металла образуют упорядоченную структуру, в которой они располагаются регулярно и проводят электрический ток.
В кристаллической решётке металлов каждый атом металла имеет ряд соседей, с которыми он образует связи. Основной особенностью металлической связи является то, что атомы металла отдают свои внешние электроны в общий свободно движущийся электронный газ. Это позволяет атомам металла обмениваться электронами и создавать структуру, которая способна проводить ток.
Металлическая связь является одной из самых сильных связей между атомами и обуславливает множество уникальных свойств металлов. В результате металлической связи между атомами металла образуется межатомная положительная заряженность, что делает металлы отличными проводниками электричества и тепла.
Также металлическая связь обуславливает способность металлов к деформации без разрушения кристаллической решётки. Это объясняется тем, что электроны в металлической связи образуют газоподобное облако, которое позволяет атомам металла свободно передвигаться и поглощать энергию деформации.
Вопрос-ответ

Как образуются металлические связи?
Металлические связи образуются благодаря электронам, свободным от определенных атомных ядер. Эти свободные электроны перемещаются вдоль кристаллической решетки металла и образуют электронное облако, которое обеспечивает связь между атомами металла.
Почему свободные электроны в металле могут перемещаться?
Электроны в металлах, в отличие от электронов в атомах, находятся в более высоких энергетических состояниях и не связаны с конкретными атомными ядрами. Это позволяет им свободно перемещаться по кристаллической решетке металла и создавать металлическую связь.
Какие особенности имеет металлическая связь?
Металлическая связь обладает несколькими особенностями. Во-первых, она обеспечивает высокую электропроводность металлов, так как свободные электроны могут легко перемещаться вдоль кристаллической решетки. Во-вторых, металлы обладают высокой пластичностью и деформируемостью, так как электронное облако позволяет атомам металла легко сдвигаться друг относительно друга. Наконец, металлическая связь обеспечивает высокую теплопроводность металлов, так как свободные электроны могут передавать энергию от одного атома к другому.
Какую роль играют атомные ядра в металлической связи?
Атомные ядра в металлической связи играют роль положительных ионов, которые притягивают свободные электроны. Эти положительные ионы образуют кристаллическую решетку металла и содействуют стабильности металлической связи. Однако, атомные ядра не оказывают прямого влияния на передвижение свободных электронов, поскольку электроны находятся в более высоких энергетических состояниях и связаны с электронным облаком, а не с конкретными ядрами.
