Металлы - это группа элементов, обладающих определенными химическими свойствами. Одним из важных факторов, влияющих на поведение металлов, является количество электронов в их внешнем электронном слое. В данной статье рассмотрим металлы, которые имеют от 4 до 7 электронов во внешнем слое.
Металлы с 4 электронами во внешнем слое, такие как титан (Ti), цирконий (Zr) и гафний (Hf), обладают высокой химической активностью. Они легко реагируют с кислородом, образуя оксиды, и с другими элементами, такими как водород и азот. Эти металлы широко используются в различных отраслях промышленности, благодаря своей прочности и коррозионной стойкости.
Металлы с 5 электронами во внешнем слое, такие как ванадий (V), ниобий (Nb) и тантал (Ta), обладают высокой прочностью и жаростойкостью. Они имеют способность образовывать стабильные соединения и сплавы с другими элементами, что делает их незаменимыми в производстве специальных сталей и сплавов, которые используются в авиации и машиностроении.
Металлы с 6 электронами во внешнем слое, такие как хром (Cr), молибден (Mo) и вольфрам (W), обладают высокой термической и химической стойкостью. Они применяются в качестве катализаторов в химической промышленности, а также в производстве высокопроизводительных материалов, таких как нержавеющая сталь и сплавы для ракетных двигателей.
Металлы с 7 электронами во внешнем слое, такие как марганец (Mn), технеций (Tc) и рений (Re), обладают химической активностью, сходной с галогенами. Они образуют различные соединения и комплексы с другими элементами, что делает их важными в качестве катализаторов и в производстве специальных легированных сталей.
Химические свойства металлов с 4-7 электронами во внешнем слое

Металлы с 4-7 электронами во внешнем слое обладают разнообразными химическими свойствами, которые определяют их реактивность и способность образовывать соединения с другими элементами. Эти металлы находятся в периоде 4-7 периодической системы.
Металлы, такие как железо, медь и никель, имеющие 4-6 электронов во внешнем слое, обычно образуют положительные ионы. Они обладают способностью терять электроны и становиться положительно заряженными. Это позволяет им вступать в реакции с другими веществами и образовывать соединения, такие как оксиды, сульфиды и соли. Например, железо может образовывать соединения с кислородом (оксиды железа) и серой (сульфиды железа).
Аллюминий, находящийся в периоде 3, с 3 электронами во внешнем слое, является особым случаем. Он также имеет способность образовывать положительные ионы, но при этом может образовывать соединения и с отрицательными ионами. Например, аллюминий образует соединения с кислородом (оксид алюминия) и хлором (хлорид алюминия).
Металлы, такие как серебро и золото, с 5-6 электронами во внешнем слое, обычно имеют низкую реактивность и малую способность к образованию соединений. Они являются химически инертными и обладают высокой стабильностью. Это делает их ценными для использования в ювелирных изделиях и в других областях, где требуется высокая устойчивость к окружающей среде.
В целом, металлы с 4-7 электронами во внешнем слое имеют разнообразные химические свойства и способность к образованию соединений. Это делает их полезными для различных применений в науке, промышленности и технологии.
Электронная конфигурация
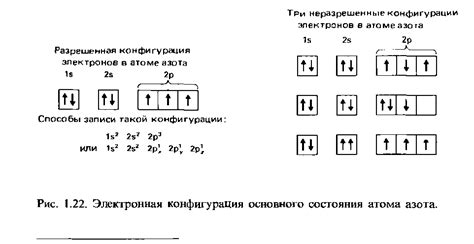
Электронная конфигурация металлов с 4-7 электронами во внешнем слое определяет их химические свойства и возможность образования соединений. Внешний слой электронов, называемый также валентным слоем, играет ключевую роль в химической активности металлов.
Например, у металлов с 4 электронами во внешнем слое, таких как титан и цирконий, обнаруживается высокая активность в реакциях, особенно с кислородом. Это вызвано тем, что эти металлы стремятся потерять электроны и образовать положительный ион с валентностью +4.
Металлы с 5 электронами во внешнем слое, например ванадий и ниобий, реагируют с кислородом, но не так активно, как металлы с 4 электронами. Их валентность может быть +5 или +4 в соединениях.
Металлы с 6 электронами во внешнем слое, как хром и молибден, имеют склонность к формированию двухсвязных соединений и имеют валентность +6 или +4 в некоторых случаях.
Наконец, у металлов с 7 электронами во внешнем слое, таких как марганец и технеций, преобладает валентность +7, что вызывает их высокую химическую активность и способность образовывать оксиды и галогениды.
Катионные свойства

Металлы с 4-7 электронами во внешнем слое обладают выраженными катионными свойствами. Они тенденциально образуют катионы, теряя 4-7 электронов именно из внешнего слоя. При этом образуется околосферический ионическим свечением слой. Создаётся действие прямой поляризации, обусловленное близостью тяжелого положительного заряда к отрицательному заряду ближайших от остатка тяжелых электронов.
Величина катионной полярности постепенно возрастает при переходе от левых металлов к металлам середины периода, где тяжёлые электроны меньше отверстию. Катионная полярность приводит к анизотропии связи между атомами при переходе от . Анизотропия полярности оказывает влияние на свойства металлов.Вследствие поляризации электрон-атомные взаимодействия ядро ЭД положительный атом ЭД отрицательные поля приобретают осевую симметрию.
К катионным свойствам металлов с 4-7 электронами во внешнем слое относятся способность образовывать положительные ионы различной степени восстановления. Например, железо может образовывать ионы с различными степенями окисления - Fe2+ и Fe3+. Это позволяет металлам совершать множество разнообразных химических реакций и образовывать соединения со множеством других веществ.
Катионные свойства металлов с 4-7 электронами также позволяют им выступать в качестве катализаторов в различных химических реакциях. Благодаря своей способности образовывать положительные ионы, они предоставляют поверхность для протекания реакций, снижая энергию активации и ускоряя химические процессы.
Образование соединений

Металлы, у которых во внешнем электронном слое содержится от 4 до 7 электронов, обладают особенными химическими свойствами. Они образуют соединения с различными элементами, включая неметаллы и металлы, что позволяет им обладать широким спектром химических реакций и использоваться в различных промышленных и научных областях.
Металлы с 4-7 электронами во внешнем слое могут образовывать ионные и ковалентные соединения. Ионные соединения характерны для металлов, у которых во внешнем слое больше 4 электронов. Они образуют катионы, отдавая свои электроны, и образуют стабильные соединения с анионами неметаллов. Ковалентные соединения, с другой стороны, характерны для металлов с 4 электронами во внешнем слое. Они образуют сопряженные ковалентные связи с другими металлами или неметаллами, образуя сложные структуры.
Образование соединений металлов с 4-7 электронами во внешнем слое обусловлено стремлением этих элементов достичь стабильной конфигурации электронов. Они могут принять или отдать электроны, чтобы достичь электронной конфигурации октета или частично заполненной оболочки. Это позволяет им образовывать различные соединения, включая соли, оксиды, гидриды и другие химические соединения с различными свойствами и применениями.
Металлы с 4-7 электронами во внешнем слое также могут образовывать комплексные соединения, в которых они координируются с другими атомами или молекулами через свои валентные электроны. Это делает их особенно полезными в катализе и синтезе органических соединений.
Реакцивность с водой
Металлы с 4-7 электронами во внешнем слое обладают различной реакцивностью с водой.
Литий является самым реактивным металлом среди них. Вода реагирует со литием, образуя легко воспламеняющийся водородный газ и гидроксид лития.
Металлы из группы 4 (титан, цирконий, гафний) и группы 5 (ванадий, ниобий, тантал) реагируют слабо или не реагируют с водой при обычных условиях. Однако, при нагревании реакция происходит. Например, титан вступает в реакцию с водой при нагревании до красного накала, образуя оксид титана и водород.
Металлы из группы 6 (хром, молибден, вольфрам) и группы 7 (марганец, технеций, рений) реагируют с водой только при нагревании до очень высоких температур.
В целом, реакция металлов с водой уменьшается по мере движения в периоде с лево на право и снижения реактивности в верхней группе металлов.
Взаимодействие с кислородом
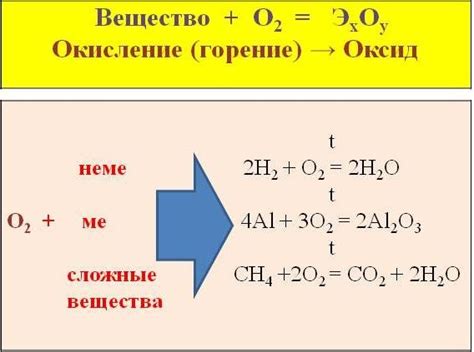
Металлы, имеющие 4-7 электронов во внешнем энергетическом уровне, проявляют активное взаимодействие с кислородом. Именно благодаря этому свойству металлы могут образовывать окислы и другие соединения с кислородом.
Взаимодействие с кислородом происходит в реакциях окисления, когда металлы передают электроны кислороду. При этом, металлы окисляются, а кислород получает электроны и вступает в состав оксидной группы.
Это взаимодействие может протекать спонтанно, без нагревания металла. Некоторые металлы, такие как натрий и калий, обладают настолько сильной реакционной способностью с кислородом, что они могут воспламеняться при простом контакте с ним в атмосфере.
Некоторые металлы, например железо и алюминий, могут образовывать защитную пленку оксида на поверхности, которая предотвращает дальнейшую реакцию с кислородом. Однако, эта пленка может быть повреждена, и в таких случаях металл может продолжить окисляться.
В целом, взаимодействие с кислородом является важным фактором, определяющим химические свойства металлов с 4-7 электронами во внешнем энергетическом уровне.
Образование сплавов

Металлы с 4-7 электронами во внешнем слое обладают особыми химическими свойствами, делая их идеальными для образования сплавов. Сплавы представляют собой материалы, состоящие из двух или более различных металлов, которые объединены в единое целое благодаря химическим реакциям между их атомами.
Процесс образования сплавов характеризуется созданием новых взаимодействий между атомами разных металлов. Одним из ключевых механизмов является образование кристаллической решетки, в которой атомы металлов занимают определенные позиции и образуют особую структуру. Эта структура называется металлической решеткой и обеспечивает сплаву его уникальные физические и химические свойства.
Сплавы можно разделить на бинарные (состоящие из двух металлов) и многокомпонентные (состоящие из трех и более металлов). Однако независимо от количества компонентов, формирование сплавов определяется характером взаимодействия между атомами металлов. Некоторые сплавы образуются с образованием сильных химических связей, что делает их более прочными и устойчивыми к окислительным процессам, в то время как другие сплавы могут иметь слабые связи и быть более подверженными коррозии.
Сплавы широко применяются в различных отраслях промышленности, таких как машиностроение, электроника, аэрокосмическая промышленность и т.д. Они обладают уникальными свойствами, такими как повышенная прочность, устойчивость к высоким температурам и агрессивным средам, хорошая проводимость электричества и тепла, а также способность к формированию сложных структур и специальных свойств, которые не могут быть достигнуты с помощью отдельных металлов.
Влияние на химическую активность
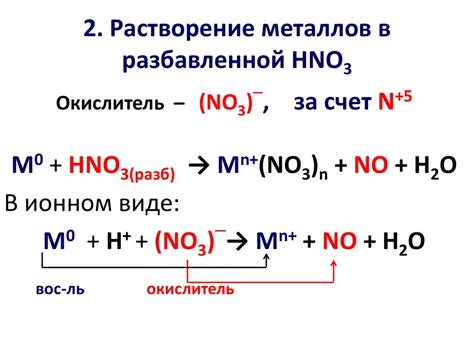
Внешняя электронная оболочка металлов, содержащих 4-7 электронов во внешнем слое, оказывает существенное влияние на их химическую активность. Эти элементы имеют особый статус, так как по количеству электронов в внешнем слое они находятся в переходном периоде между металлами и неметаллами.
На химическую активность металлов с внешней электронной оболочкой, содержащей 4-7 электронов, влияют следующие факторы:
- Количество электронов: Чем больше электронов во внешнем слое, тем больше энергии необходимо для их отрыва от атома. Это делает эти металлы менее активными в химических реакциях.
- Доступность электронов: Возможность доступа к электронам во внешнем слое металла также влияет на его активность. Если электроны хорошо доступны для образования связей с другими атомами, металл будет более активным.
- Наличие свободных орбиталей: Некоторые металлы с 4-7 электронами во внешнем слое имеют свободные орбитали, которые обеспечивают им возможность образовывать координационные соединения. Это значительно повышает их химическую активность.
Изучение свойств и химической активности металлов с 4-7 электронами во внешнем слое имеет большое значение в научном и промышленном плане, поскольку позволяет предсказывать и контролировать их реакционную способность и использовать их в различных областях, включая катализ и электрохимию.
Роль металлов с 4-7 электронами во внешнем слое в жизни растений и животных
Металлы с 4-7 электронами во внешнем слое, такие как железо, цинк, медь, марганец и никель, играют важную роль в жизни растений и животных. Они являются важными микроэлементами, необходимыми для нормального функционирования многих биологических процессов.
У животных эти металлы играют роль в составе ферментов и других белков, необходимых для регуляции обмена веществ. Например, железо является частью гемоглобина - вещества, отвечающего за транспорт кислорода в организме. Медь необходима для синтеза коллагена, основного компонента соединительной ткани. Цинк участвует в обмене гормонов и росте, а марганец необходим для нормального функционирования нервной системы.
В растениях металлы с 4-7 электронами во внешнем слое также выполняют важные функции. Они являются неотъемлемой частью ферментов и белков, контролирующих фотосинтез и другие процессы питания. Например, марганец необходим для синтеза хлорофилла, благодаря которому растения могут поглощать световую энергию и выполнять фотосинтез. Цинк и медь участвуют в метаболизме азота, необходимом для роста и развития растений.
В целом, металлы с 4-7 электронами во внешнем слое имеют существенное значение для живых организмов. Они обеспечивают нормальное функционирование различных биохимических процессов, необходимых для жизни и развития растений и животных. Недостаток или избыток этих микроэлементов может привести к нарушениям в организме и возникновению различных заболеваний.
Вопрос-ответ

Какие металлы имеют 4 электрона во внешнем слое?
Металлы, имеющие 4 электрона во внешнем слое, называются четырехвалентными металлами. К ним относятся многие элементы периодической системы, такие как углерод (С), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb). Они обладают характерными химическими свойствами и находят применение в различных отраслях промышленности.
Какие химические свойства проявляют металлы с 5 электронами во внешнем слое?
Металлы с 5 электронами во внешнем слое называются пятивалентными металлами. Некоторые примеры таких металлов включают антимон (Sb), арсений (As), висмут (Bi), йод (I) и хром (Cr). Они обладают свойством образовывать соединения с 5-кратным зарядом и способны проявлять разнообразные химические реакции. Некоторые из них, например, хром, используются в производстве красок и пигментов, а другие, такие как антимон, имеют медицинские и промышленные применения.
