Атомы металлов – это основные строительные блоки всех металлических материалов. Они состоят из ядра, где сосредоточена большая часть массы атома, и облака электронов, обращающихся вокруг ядра на энергетических уровнях. Количество электронов, находящихся в облаке вокруг ядра, может быть разным для разных металлов.
Согласно принципу Паули, каждый электрон в атоме металла должен занимать уникальное квантовое состояние. Это означает, что каждый электрон должен иметь свой уникальный набор квантовых чисел, таких как главное, орбитальное и магнитное квантовые числа. Эти числа определяют энергию электрона и его спиновый момент, и они могут принимать только дискретные значения.
В результате таких квантовых ограничений число возможных электронных состояний в атоме металла оказывается ограниченным. Количество электронов в атоме металла может быть равным числу электронов, взятому частями, квантованному как "250 тратиллионов триллионов" в атомах платины, например. Однако, в среднем атомы металлов имеют около 30-90 электронов в зависимости от своей позиции в таблице Менделеева.
Таким образом, несмотря на то, что атомы металлов являются относительно простыми с точки зрения их структуры, они обладают ограниченным числом электронных состояний. Это ограничивает максимальное количество электронов, которое может находиться в атоме металла и определяет его химические свойства.
Структура атомов металлов

Атомы металлов имеют определенную структуру, которая определяет их свойства и поведение в химических реакциях. Они состоят из положительно заряженного ядра и облака отрицательно заряженных электронов, которые обращаются по определенным орбитам.
Ядро атома металла содержит протоны, которые имеют положительный заряд, и нейтроны, которые не имеют электрического заряда. Протоны и нейтроны находятся в центре атома и называются ядерным электроном.
Вокруг ядра атома металла находится облако электронов, которое образует электронную оболочку. Электроны движутся по орбитам или энергетическим уровням, которые определяются их энергией. Они могут находиться на разных орбитах, каждая из которых может содержать определенное количество электронов.
Количество электронов в энергетической оболочке металла зависит от его атомного номера и места в периодической системе элементов. Например, у атома натрия, который имеет атомный номер 11, электронная конфигурация состоит из 2 электронов на первой энергетической оболочке и 8 электронов на второй энергетической оболочке. В результате, у атома натрия всего 1 электрон на внешней оболочке, что делает его реакционно способным.
Сферы электронного облака
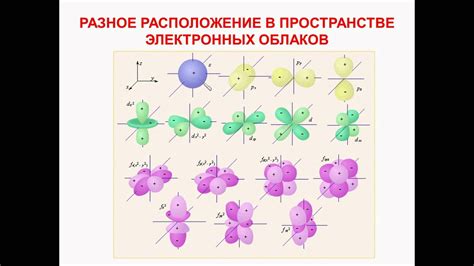
Сферы электронного облака являются частью модели атомов металлов, которая позволяет представить расположение электронов вокруг ядра. В атоме металла электроны находятся в разных энергетических уровнях, которые представлены в виде сфер. Каждая сфера соответствует определенному энергетическому уровню.
Сферы электронного облака образуются благодаря тому, что электроны имеют определенные энергии и могут находиться на разных дистанциях от ядра. Чем выше энергетический уровень, тем дальше электрон находится от ядра и тем больше его сфера электронного облака.
Количество сфер электронного облака в атоме металла ограничено. В основном, атомы металлов имеют ограниченное количество энергетических уровней и, следовательно, ограниченное количество сфер. Это связано с особенностями строения атомов металлов и их электронной оболочки.
Количество сфер электронного облака также зависит от количества электронов, которые находятся в атоме металла. Каждая сфера может вмещать ограниченное количество электронов. Таким образом, количество сфер электронного облака определяется количеством электронов в атоме металла.
Ядро атома металла
Ядро атома металла является одной из основных составляющих этой химической системы. Ядро представляет собой компактную часть атома, содержащую протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Вместе они образуют ядро атома, которое обладает положительным зарядом.
Ядро атома металла имеет большую плотность и массу по сравнению с электронами, которые находятся вокруг него. Протоны и нейтроны собраны вместе в центре атома, образуя ядро, которое занимает незначительное пространство в атоме. Электроны, в свою очередь, находятся на различных энергетических уровнях вокруг ядра.
Ядро атома металла играет важную роль в его химических свойствах. Вся химическая активность атома зависит от взаимодействия электронов с ядром и друг с другом. Ядро является не только источником притяжения для электронов, но и местом, где происходят ядерные реакции.
- Протоны в ядре определяют заряд атома, который равен количеству протонов минус количество электронов.
- Нейтроны в ядре играют роль "клейких" частиц, поддерживая стабильность ядра и препятствуя его разрушению.
- Количество протонов и нейтронов в ядре влияет на массу и стабильность атома металла.
Таким образом, ядро атома металла является основной структурной единицей, определяющей его химические свойства и поведение в химических реакциях.
Количество электронов в атомах металлов

Количество электронов в атомах металлов определяется структурой электронной оболочки. Каждый атом металла имеет определенное количество электронов, которые располагаются на различных энергетических уровнях. Это количество электронов влияет на свойства и химическую активность металла.
В атоме металла есть основной уровень энергии, на котором располагается наибольшее количество электронов. Количество электронов на этом уровне определяется по номеру группы элемента в таблице Менделеева. Например, металлы из первой группы (например, литий, натрий) имеют один электрон на основном уровне.
Однако, некоторые металлы имеют дополнительные энергетические уровни, на которых располагается дополнительное количество электронов. Эти дополнительные уровни называются внутренними или подуровнями. Например, металлы переходных элементов имеют дополнительные уровни, на которых могут находиться до 10 электронов.
Также, электроны в атомах металлов могут образовывать пары, заполняя энергетические уровни с одинаковым спином. Это свойство электронов называется спиновой парностью. Спиновая парность позволяет электронам занимать одни и те же энергетические уровни, что влияет на внутреннюю структуру металлической решетки и свойства металла.
Таблица Менделеева позволяет определить общий порядок электронов в атомах металлов, но точное количество электронов может изменяться в зависимости от изотопа металла и его окружения в соединении. Таким образом, количество электронов в атомах металлов является важным параметром, определяющим их свойства и химическую активность.
Электронные оболочки атомов металлов

Атомы металлов состоят из ядра, которое содержит протоны и нейтроны, и внешних электронных оболочек, которые окружают ядро. Электроны в оболочках атомов металлов играют важную роль в их химических свойствах и взаимодействии с другими веществами.
Оболочки атомов металлов состоят из различных энергетических уровней, на которых расположены электроны. Каждый уровень может содержать определенное количество электронов. Это количество определяется формулой 2n^2, где n - номер энергетического уровня. Например, первый уровень может содержать максимум 2 электрона, второй - 8 электронов, третий - 18 и так далее.
У атомов металлов внешние оболочки, называемые валентными оболочками, играют особую роль в их химической активности. Валентные электроны находятся на наиболее удаленной от ядра оболочке и обуславливают способность металлов вступать в химические реакции и образование связей с другими атомами.
Поэтому, количество электронов в валентной оболочке атомов металлов не превышает нескольких десятков, что значительно меньше, чем общее количество электронов во всех оболочках. Это делает металлы химически активными элементами, способными образовывать стабильные соединения и проводить электричество.
Валентные и обычные электроны
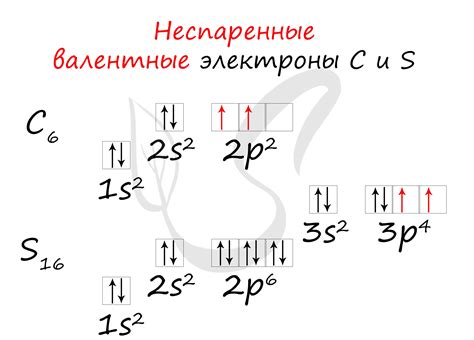
Валентные электроны - это электроны, находящиеся на последней заполненной энергетической оболочке атома металла. Они играют ключевую роль в химических реакциях и определяют химические свойства элемента. Количество валентных электронов определяется группой элемента в таблице Менделеева.
Обычные электроны - это все остальные электроны, кроме валентных. Они находятся на внутренних энергетических оболочках и слабо участвуют в химических реакциях. Количество обычных электронов в атоме металла может быть значительно больше, чем количество валентных.
Различие между валентными и обычными электронами обусловлено структурой энергетических уровней атома. Валентные электроны находятся на наиболее отдаленной от ядра оболочке и имеют более высокую энергию, чем обычные. Это делает их более подвижными и способными к участию в химических реакциях.
Количество валентных электронов в атоме металла ограничено по принципу октета - наличию 8 электронов на валентной оболочке, что обеспечивает наиболее стабильное состояние атома. Валентные электроны могут образовывать химические связи с электронами других атомов, образуя молекулы и кристаллические структуры. Это объясняет почему количество валентных электронов в атомах металлов не так велико.
Вопрос-ответ

Почему количество атомов металлов не так велико?
Количество атомов металлов не так велико из-за свойств самого металла. Металлы обладают высокой плотностью и массой атомов, что означает, что их атомы занимают меньшее пространство по сравнению с атомами других элементов. Это делает количество атомов металлов относительно небольшим.
Почему атомы металлов имеют малое количество электронов?
Атомы металлов имеют малое количество электронов из-за особенностей их электронной структуры. Металлы находятся в левой части периодической системы элементов и имеют небольшое количество электронов в своих энергетических оболочках. Это связано с тем, что атомы металлов имеют относительно низкую электроотрицательность, что влияет на их способность привлекать и удерживать электроны. Кроме того, металлы, как правило, образуют положительные ионы (катионы), отдавая один или несколько своих электронов, что дополнительно снижает количество электронов в атомах металлов.
