Металлы – это класс веществ, отличающийся от других материалов наличием особенной структуры атомов. Атомы металлов имеют определенное количество электронов на внешнем электронном уровне, что делает их особенно активными и важными для химических реакций.
Внешний электронный уровень атомов металлов, называемый также валентным или последним, имеет определенное количество электронов. У большинства металлов внешний уровень содержит 1, 2 или 3 электрона. Эти электроны обладают особой энергией и могут свободно перемещаться между атомами, образуя так называемый "море электронов". Это обуславливает высокую электропроводность, теплопроводность и пластичность металлов.
Внешний уровень электронов в атомах металлов играет ключевую роль в химических реакциях. Эти электроны способны образовывать и разрывать химические связи, обмениваться с другими атомами и ионами. Наличие свободных электронов на внешнем уровне позволяет металлам проявлять высокую активность при контакте с другими веществами.
В итоге, внешний уровень электронов делает атомы металлов особенно реакционноспособными и позволяет им образовывать различные химические соединения, включая ионные и молекулярные соединения.
Структура атомов металлов

Атомы металлов имеют особую структуру, которая определяет их химические и физические свойства. Основу атома металла составляет ядро, в котором находятся протоны и нейтроны. Вокруг ядра располагаются электроны, которые образуют электронную оболочку.
Электронная оболочка атомов металлов состоит из нескольких уровней энергии. Наиболее близкий к ядру уровень энергии называется первым или K-уровнем. На этом уровне может находиться не более 2 электронов. Следующий уровень энергии называется вторым или L-уровнем и может содержать до 8 электронов. Также металлы могут иметь дополнительные уровни энергии – M, N и т.д.
На внешнем уровне энергии, который называется валентным или внешним, находятся электроны, определяющие химические свойства атома металла. Количество электронов на валентном уровне может различаться у разных металлов и определяет их способность образовывать химические связи.
Структура атомов металлов делает их особенно подходящими для образования ионов. Металлы легко отдают электроны и образуют положительно заряженные ионы. При этом атом металла становится ионом и получает положительный заряд, равный числу отданных электронов.
Исходя из структуры атомов металлов, можно сделать вывод, что они являются хорошими проводниками электричества. Электроны на валентном уровне свободно передвигаются по металлической структуре и создают электрический ток.
Внешний уровень электронов
Внешний уровень электронов является самым удаленным от ядра атомного уровнем электронной оболочки. Он определяет химические свойства атома металла и его способность к реакциям с другими элементами. Внешний уровень электронов также называется валентным уровнем.
На внешнем уровне электронной оболочки атома металла находятся валентные электроны, которые отвечают за образование химических связей с другими атомами. Количество валентных электронов может быть определено на основе расположения элемента в периодической таблице и его группы. Валентные электроны могут участвовать в обмене, передаче или образовании электронных связей с другими атомами.
Количество валентных электронов определяет химические свойства атома металла. Чем больше валентных электронов, тем больше элемент способен образовывать химические связи с другими атомами и участвовать в реакциях. Валентные электроны могут образовывать общие или ионные связи с другими атомами, что позволяет атому металла образовывать соединения и влиять на их физические и химические свойства.
Валентные электроны атомов металлов также могут образовывать металлические связи, которые характеризуются свободным передвижением электронов между атомами. Это позволяет металлам обладать специфическими физическими свойствами, такими как электропроводность и теплопроводность. Валентный уровень электронов является ключевым параметром при изучении свойств металлов и составлении химических реакций.
Роль внешнего уровня электронов
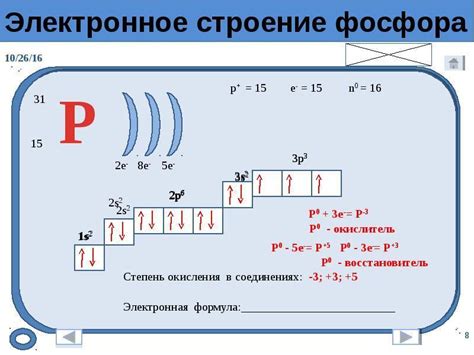
Внешний уровень электронов в атоме металла играет важную роль в его химической активности и свойствах. Он определяет, каким образом металл будет взаимодействовать с другими веществами и формировать химические связи. Внешний уровень электронов состоит из валентных электронов либо последнего заполненного энергетического уровня, либо последнего заполненного подуровня.
Количество валентных электронов определяет химическую активность металла. Например, металлы с одним валентным электроном, такие как литий и натрий, легко реагируют с водой и образуют гидроксиды. С другой стороны, металлы с множеством валентных электронов, такие как железо и алюминий, менее активны химически и образуют оксиды.
Внешний уровень электронов также влияет на электрические и тепловые свойства металлов. Наличие свободных электронов на внешнем уровне позволяет металлам проводить электричество и тепло. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью, что делает их полезными для множества промышленных и электротехнических приложений.
Изучение внешнего уровня электронов позволяет понять основные свойства и поведение металлов. Такой подход применяется в химии и материаловедении для исследования и создания новых материалов с определенными свойствами. Помимо этого, понимание влияния внешнего уровня электронов позволяет разрабатывать новые методы синтеза и обработки металлических материалов с учетом их химической активности.
Ионизация атомов металлов

Ионизация атомов металлов - это процесс, при котором атом металла теряет или получает электроны, превращаясь в ион с положительным или отрицательным зарядом. Ионизация атомов металлов происходит на внешнем уровне электронов, который содержит от одного до восьми электронов.
Ионизация атомов металлов может происходить путем потери электронов (катионизация) или путем получения дополнительных электронов (анионизация). При катионизации атом металла становится положительно заряженным, так как теряет один или несколько электронов из своего внешнего уровня. При анионизации атом металла получает дополнительные электроны на своем внешнем уровне и становится отрицательно заряженным.
Ионизация атомов металлов может происходить под воздействием различных факторов, таких как температура, давление, электромагнитное излучение или взаимодействие с другими веществами. Например, под воздействием высоких температур атомы металлов приобретают достаточную энергию для отрыва электронов и их ионизации. Также, электромагнитное излучение может воздействовать на атомы металлов, вызывая у них ионизацию.
Ионизация атомов металлов играет важную роль во многих процессах и явлениях, связанных с металлами. Например, ионизация металлов может привести к образованию плазмы, которая способна проводить электрический ток и обладает свойствами, которые используются в различных технологиях, таких как плазменная сварка или плазменное распыление материалов. Кроме того, ионизация металлов может играть важную роль в химических реакциях, участвуя в образовании соединений с другими веществами.
Важность внешнего уровня электронов
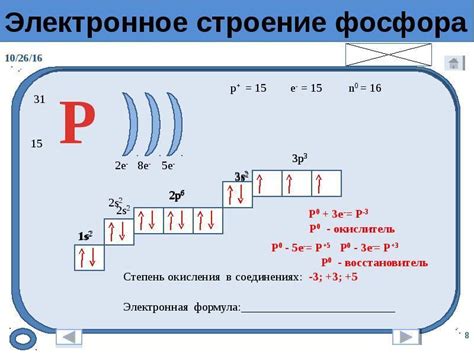
Внешний уровень электронов в атоме металлов играет важную роль в их химических свойствах. Этот уровень определяет способность металла вступать в реакции с другими веществами, а также его электропроводность и термическую проводимость.
На внешнем уровне электронов находятся валентные электроны, которые ответственны за химические связи металла с другими элементами. Количество валентных электронов определяет химическую активность металла и его способность образовывать соединения.
Валентные электроны также отвечают за электропроводность металлов. Они свободно передвигаются по кристаллической решетке металла и образуют электронный газ. Благодаря этому свойству металлы обладают высокой электропроводностью и используются в различных электрических устройствах.
Кроме того, внешний уровень электронов влияет на термическую проводимость металлов. Валентные электроны передают тепловую энергию от одного атома к другому, обеспечивая хорошую теплопроводность металлов.
Электроотрицательность атомов металлов

Электроотрицательность - это характеристика атома металла, которая определяет его способность притягивать к себе электроны в химической связи. Обычно атомы металлов имеют низкую электроотрицательность в сравнении с неметаллами.
Металлы в периодической системе расположены слева от периода. Их атомы имеют обычно один или несколько валентных электронов в своем внешнем энергетическом уровне. Они готовы отдавать эти электроны для образования положительных ионов и формирования металлической связи.
Низкая электроотрицательность атомов металлов обусловлена их преобладающими размерами и является ключевым фактором для образования металлических связей. Имея низкую электроотрицательность, атомы металлов слабо притягивают электроны, создавая общедоступные электроны, которые свободно перемещаются в кристаллической решетке металла. Это обусловливает множество свойств металлов: хорошую электропроводность, теплопроводность, пластичность и металлический блеск.
Электроотрицательность атомов металлов важна при реакциях металлов с неметаллами. Низкая электроотрицательность металла позволяет ему легко отдавать электроны неметаллу, которые образуют ионические соединения. В этом случае атом металла становится положительным ионом, а атом неметалла - отрицательным ионом, что обеспечивает стабильность соединения.
Химические свойства металлов

Металлы обладают рядом особенных химических свойств, которые обусловлены особенностями их атомных структур и внешним уровнем электронов.
Один из основных факторов, определяющих химические свойства металлов, это их способность образовывать положительные ионы. Внешний электронный уровень металлов часто содержит мало электронов, что позволяет им легко отдавать электроны и образовывать положительные ионы. Эта способность делает металлы отличными проводниками электричества и тепла.
Также металлы обладают высокой реакционной способностью. Они способны вступать в химические реакции с различными веществами, такими как кислород, вода и другие соединения. Это происходит благодаря тому, что у металлов внешний электронный уровень находится далеко от ядра, и электроны на этом уровне ослаблены электростатическим притяжением ядра, что делает их более подвижными и более легкими для вступления в реакции.
Еще одной химической особенностью металлов является их способность образовывать металлические связи. Атомы металлов в твердом состоянии образуют кристаллическую решетку, в которой электроны на внешних энергетических уровнях не принадлежат одному конкретному атому, а свободно передвигаются по всему кристаллу. Это обеспечивает высокую электропроводность и любопытные физические свойства металлов, такие как блеск, пластичность и хорошая теплопроводность.
Вопрос-ответ

Что такое атомы металлов?
Атомы металлов - это мельчайшие частицы, из которых состоят металлы. Они имеют положительно заряженное ядро и окружены облаком электронов.
Какие электроны находятся на внешнем уровне атомов металлов?
На внешнем уровне атомов металлов находятся валентные электроны. Они обладают свободной энергией и являются ответственными за химические свойства металлов.
