Атомы металлов имеют особенную структуру электронных оболочек, которая отличает их от атомов других элементов. На самом внешнем уровне электронной оболочки атомов металлов располагается всего 1-3 электрона.
Этот факт объясняет основные свойства металлов, такие как высокая электропроводность, теплопроводность, пластичность и малые значения электронного аффинитета и ионизационной энергии. Низкое количество электронов во внешней оболочке обеспечивает высокую подвижность электронов и возможность легкого перемещения их по металлической решетке.
Благодаря этим особенностям металлы способны образовывать металлические связи, которые являются одной из причин их высокой пластичности и хорошей проводимости электричества и тепла. Кроме того, наличие всего нескольких электронов на внешнем уровне оболочки атома металла способствует его активности в химических реакциях, что делает металлы отличными катализаторами.
Структура электронных оболочек металлических атомов
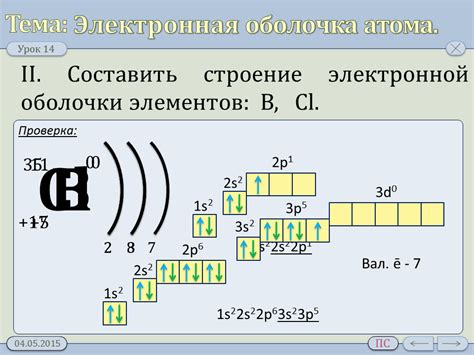
Металлы отличаются особой структурой электронных оболочек своих атомов. В основе этой структуры лежит особенность распределения электронов в энергетических уровнях. У металлических атомов количество электронов в оболочке может быть различным, но в данном случае рассматриваем только те металлы, у которых нарушено правило заполнения энергетических уровней и в оболочке находится всего 1-3 электрона.
Первый энергетический уровень, на котором располагаются электроны в электронной оболочке металлических атомов, заполняется двумя электронами. Этот уровень называется K-оболочкой. Вторая энергетическая оболочка, L-оболочка, вмещает до восьми электронов, но у металлов, которые имеют всего 1-3 электрона в оболочке, эта оболочка заполняется только одним или двумя электронами.
Когда в L-оболочке находится всего один электрон, он сильно притягивается ядром атома и может легко участвовать в химических реакциях. Это делает металл активным химическим элементом. Когда в L-оболочке находится два электрона, они образуют пару и оба электрона участвуют в химических связях металла.
Такая структура электронных оболочек металлических атомов определяет их химическое поведение. Металлы с одним электроном в оболочке, такие как литий и натрий, легко отдают этот электрон, что делает их активными металлами. Металлы с двумя электронами в оболочке, такие как магний и кальций, могут участвовать в образовании ионов с положительным зарядом, но не так активно, как металлы с одним электроном.
Количество электронов в электронных оболочках металлов

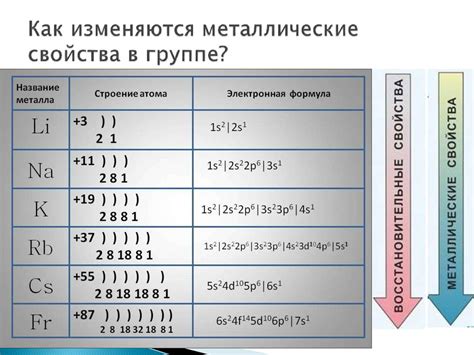
Количество электронов в электронных оболочках металлов может варьироваться от 1 до 3. Эти металлы находятся в первой, второй и третьей группах периодической таблицы элементов, соответственно.
В первой группе находятся щелочные металлы, такие как литий, натрий и калий. У них в электронных оболочках наибольшее количество электронов - 1. Эти металлы легко отдают свой единственный электрон, образуя положительные ионы. Именно этот процесс позволяет им проявлять свои металлические свойства, такие как хорошая электропроводность и теплопроводность.
Во второй группе находятся щелочноземельные металлы: бериллий, магний, кальций и другие. У них в электронных оболочках уже два электрона. Эти металлы также обладают металлическими свойствами, хотя и не такими выраженными, как у щелочных металлов. Они могут отдать два электрона, образуя положительные ионы с двумя зарядами.
Третья группа содержит металлы переходного типа, такие как алюминий, галлий, индий. У них в электронных оболочках находится три электрона. Эти металлы проявляют свои уникальные свойства благодаря способности образовывать различные степени окисления в соединениях.
Металлические атомы и их электронные оболочки

Металлические атомы состоят из ядра, в котором находятся протоны и нейтроны, а вокруг ядра расположены электронные оболочки. Эти оболочки состоят из электронов, которые образуют электронную оболочку атома. В металлах обычно есть от 1 до 3 электронов на внешней электронной оболочке.
Внешние электроны, также называемые валентными электронами, играют важную роль в химическом поведении и свойствах металлов. Именно они определяют способность металла образовывать химические связи и вступать в реакции с другими веществами.
Валентные электроны металлических атомов обладают меньшей энергией, чем внутренние электроны, и поэтому они связываются слабее с ядром. Это делает металлы отличными проводниками электричества и тепла, так как валентные электроны могут свободно передвигаться по кристаллической решетке металла.
Внешние электроны также определяют химическую реактивность металлов. Они могут легко ионизироваться и образовывать положительно заряженные ионы, которые притягивают отрицательно заряженные частицы и образуют химические соединения. Валентные электроны могут создавать орбитали, образуя идеально упакованные кристаллические структуры металлов.
Основные свойства электронных оболочек металлов
1. Электронное строение: Электронные оболочки металлов можно описать с помощью электронной конфигурации. В основном, металлы имеют один-три электрона в своей внешней оболочке. Это делает их электронно нестабильными и способствует их химической активности.
2. Проводимость тепла и электричества: Металлы характеризуются высокой электрической и теплопроводностью. Это объясняется наличием свободных электронов в их внешних оболочках, которые могут свободно двигаться и переносить электрический ток или тепло.
3. Металлический блеск: Металлы обладают характерным металлическим блеском. Это объясняется способностью свободных электронов в металлах поглощать и переизлучать свет.
4. Деформация и пластичность: Металлы обладают высокой пластичностью и деформируются без прочного разрушения. Это явление объясняется свободными дорожками, по которым металлические ионы могут смещаться под действием внешних сил.
5. Металлическая связь: Металлы образуют металлическую связь, которая характеризуется тем, что электроны в валентной оболочке находятся в общем использовании у всех атомов металла. Такая связь обеспечивает прочность и устойчивость металлической решетки.
Формирование характерных свойств металлов

Атомы металлов обладают особенностью – у них на электронной оболочке всего 1-3 электрона. Такая конфигурация электронной оболочки является причиной формирования характерных свойств металлов.
При наличии небольшого количества электронов на внешней оболочке, атомы металлов обладают высокой проводимостью электричества. Электроны легко перемещаются по металлической структуре и создают электронный газ. Этот электронный газ играет роль "клейких" сил, который обеспечивает металлическую связь между атомами. Благодаря этому металлы обладают высокой пластичностью и обрабатываемостью.
Также малое количество электронов на внешней оболочке является причиной формирования химической активности металлов. Атомы металлов готовы отдавать один или несколько электронов, чтобы достичь электронной конфигурации стабильного инертного газа. Это обусловливает способность металлов к образованию солей и окислов, а также их способность к реакциям с кислородом и другими веществами.
Таким образом, формирование характерных свойств металлов определяется особенностями электронной оболочки атомов. Наличие всего 1-3 электронов на внешней оболочке обусловливает высокую проводимость электричества, пластичность и обрабатываемость металлов, а также их химическую активность и способность к реакциям с другими веществами.
Вопрос-ответ

Каким образом организованы электронные оболочки атомов металлов?
Электронные оболочки атомов металлов состоят из нескольких энергетических уровней, на которых располагаются электроны. Самая ближняя к ядру оболочка называется первой электронной оболочкой и может содержать не более 2 электронов. На следующей оболочке, второй электронной, могут находиться до 8 электронов. На третьей оболочке может быть от 1 до 18 электронов, но обычно эта оболочка содержит только 1-3 электрона при рассмотрении атомов металлов.
Почему электронные оболочки атомов металлов имеют всего 1-3 электрона?
Электронные оболочки атомов металлов имеют всего 1-3 электрона, потому что атомы металлов обладают малым количеством внешних электронов. Внешние электроны, находясь в электронной оболочке с самым высоким энергетическим уровнем, отвечают за химические свойства атома. В металлах эти электроны обладают особыми свойствами, что делает металлы хорошими проводниками электричества и тепла.
Какое значение имеют электронные оболочки металлических атомов с 1-3 электронами?
Электронные оболочки металлических атомов с 1-3 электронами имеют большое значение, так как именно внешние электроны определяют химические свойства металлов. В металлах эти электроны свободно двигаются по всей структуре кристаллической решетки и образуют "море" электронов. Это позволяет металлам быть отличными проводниками электричества и тепла, а также обладать другими специфическими свойствами, такими как гибкость, пластичность и блеск.
