Атомные массы двухвалентных металлов в соединениях с фтором - это важный аспект изучения химических свойств элементов и их соединений. Фтор, обладая высокой электроотрицательностью, образует с металлами в основном ионные соединения, где металл играет роль катиона, а фтор - аниона.
Одной из закономерностей, отмеченной в исследованиях, является увеличение атомной массы металла при росте массовой доли фтора в соединении. Данное явление можно объяснить тем, что увеличение массовой доли фтора приводит к увеличению количества фторидных ионов в соединении, что требует большего количества металла для образования ионов и балансировки заряда.
Эта закономерность можно проиллюстрировать на примере таких двухвалентных металлов, как кальций, стронций и барий. Кальций образует соединения с фтором, например, CaF2, где массовая доля фтора составляет 60%. Атомная масса кальция в этом соединении равна 40, а атомная масса фтора - 19. Следовательно, отношение атомной массы кальция к массовой доле фтора будет равно 40/0.6 = 66.7.
Аналогично можно рассчитать отношение атомных масс стронция и бария к массовой доле фтора в их соединениях с фтором. Путем сравнения значений можно выявить общую закономерность в отношении атомных масс двухвалентных металлов к массовой доле фтора и провести соответствующие выводы.
Особенности атомных масс двухвалентных металлов
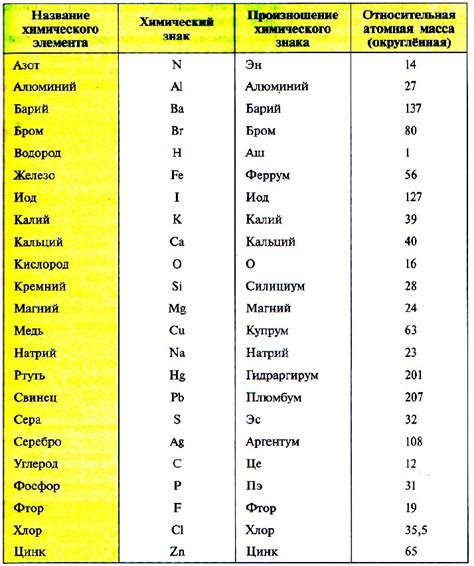
Двухвалентные металлы представляют собой группу химических элементов, которые способны образовывать соединения с валентностью два. Наиболее известными представителями этой группы являются металлы щелочных земель, такие как магний, кальций, стронций и барий.
Атомные массы двухвалентных металлов имеют свои особенности, связанные с их валентностью и свойствами. Валентность два означает, что эти металлы могут образовывать соединения, в которых атом металла обменивает два электрона с другими атомами или ионами. Вследствие этого происходит изменение их атомной массы.
Например, атомный масса магния равна примерно 24,3 г/моль, в то время как атомная масса кислорода составляет примерно 16 г/моль. В соединениях, где магний проявляет свою валентность два, каждый атом магния будет обменивать два электрона с атомами кислорода. Это приводит к увеличению массы атома магния в соединении.
Табличные данные об атомных массах двухвалентных металлов помогают установить закономерности в отношении массовой доли фтора в соединениях. Такие данные позволяют установить зависимость между массой металла и его массовой долей в различных соединениях с фтором, что важно при проведении химических расчетов и анализе соединений.
Следует отметить, что атомные массы металлов и их массовые доли в соединениях могут варьироваться в зависимости от конкретной химической реакции или условий, в которых происходит образование соединений. Поэтому использование данных об атомных массах двухвалентных металлов требует внимательного анализа и учета всех факторов, влияющих на формирование соединений.
Атомные массы: определение, значение, закономерности
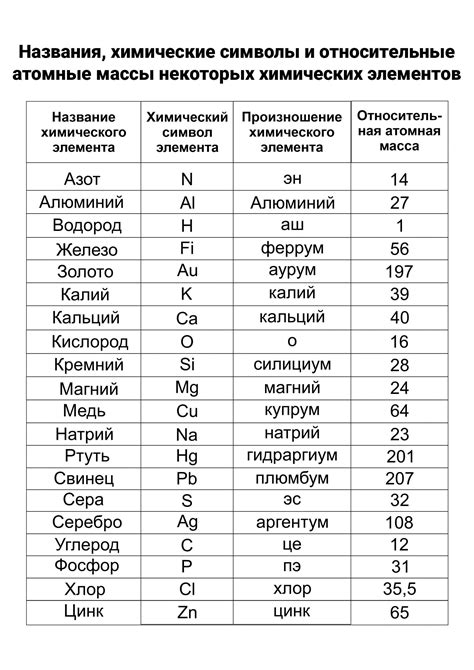
Атомная масса – это физическая величина, которая характеризует массу одного атома вещества. Единицей измерения атомной массы является атомная массовая единица (АМЕ), равная 1/12 массы атома углерода-12. Атомная масса определяется количеством протонов и нейтронов в ядре атома.
Значение атомной массы имеет большое значение для химических и физических расчетов, поскольку оно влияет на реакционную способность вещества. Различия в атомных массах могут приводить к различиям в химическом поведении и свойствах разных элементов.
В закономерностях отношения атомных масс двухвалентных металлов к массовой доле фтора можно выделить следующие закономерности. Во-первых, с увеличением атомной массы двухвалентного металла, массовая доля фтора восходит. Это связано с тем, что более тяжелые металлы имеют большую возможность связаться с фтором. Во-вторых, с ростом массовой доли фтора, атомная масса металла также возрастает. Это обусловлено тем, что фтор имеет малую атомную массу, поэтому его присутствие в соединении влияет на общую атомную массу.
Понимание закономерностей в отношении атомных масс и массовых долей фтора имеет значительное значение для изучения химических свойств и реакционной способности двухвалентных металлов. Такие закономерности позволяют предсказать свойства и поведение веществ, а также проводить расчеты в химической промышленности и научных исследованиях.
Атомные массы двухвалентных металлов
Атомные массы двухвалентных металлов являются одними из основных характеристик этих элементов. Двухвалентные металлы - это элементы, у которых ионы имеют два положительных заряда. В периодической таблице элементов они расположены во второй группе, так как имеют два электрона во внешней электронной оболочке.
Атомные массы двухвалентных металлов определяются как средневзвешенная масса всех изотопов данного элемента. Изотопы - это атомы одного и того же элемента, но с разным числом нейтронов в ядре. Изотопы могут иметь разную атомную массу, но обладать одним и тем же количеством протонов и электронов.
Атомные массы двухвалентных металлов обычно выражаются в атомной массовой единице (аму) или граммах на моль (г/моль). Атомная массовая единица - это масса одного атома углерода-12. Она равна примерно 1,66 × 10^-27 кг.
Для удобства сравнения атомных масс двухвалентных металлов с использованием реагентов составляются таблицы, в которых указывается их атомная масса и пропорции с другими элементами. Эти таблицы помогают определить соотношение массовых долей фтора и двухвалентных металлов в различных химических соединениях.
Массовая доля фтора: определение и роль

Массовая доля фтора – это параметр, показывающий, какая часть массы вещества приходится на фтор. Выражается в процентах или долях единицы массы. Массовая доля фтора является ключевым показателем в исследованиях, связанных с взаимодействием фтора с другими химическими элементами.
Роль массовой доли фтора в исследованиях атомных масс двухвалентных металлов заключается в установлении закономерностей между этим показателем и другими химическими свойствами металлов. Атомные массы двухвалентных металлов, таких как магний, цинк, никель и многие другие, имеют прямую зависимость от массовой доли фтора.
Для анализа этой зависимости проводятся специальные эксперименты и измерения, в которых изучается влияние фтора на физические и химические свойства металлов. Результаты исследований помогают установить принципы и закономерности, которые позволяют уточнить и предсказать свойства различных двухвалентных металлов в зависимости от их массовой доли фтора.
Изучение массовой доли фтора имеет практическое значение в различных областях науки и промышленности, таких как производство сплавов и металлизированных материалов, производство легированных сталей и т.д. Правильный расчет и контроль массовой доли фтора позволяет получить материалы с определенными характеристиками и свойствами, что является важным фактором для создания новых материалов и разработки новых технологий.
Закономерности в отношении массовой доли фтора

Массовая доля фтора может быть определена в составе различных соединений, включающих двухвалентные металлы. Изучение связи между массовой долей фтора и атомными массами двухвалентных металлов позволяет обнаружить некоторые закономерности и тренды.
Один из основных закономерностей в отношении массовой доли фтора состоит в том, что она обычно увеличивается с увеличением атомной массы металла. Это может быть объяснено тем, что атомы металла с более высокой атомной массой имеют большую тенденцию образовывать ионные связи с фтором.
При просмотре таблицы атомных масс двухвалентных металлов и их массовых долей фтора можно заметить следующие закономерности:
- Общая тенденция состоит в том, что чем выше атомная масса металла, тем выше его массовая доля фтора.
- Некоторые металлы, такие как кальций (Ca) и стронций (Sr), имеют атомные массы, близкие друг к другу, и следовательно, их массовые доли фтора также близки. Это указывает на сходство химической природы этих металлов.
- Однако наблюдаются и исключения из общих закономерностей. Например, массовая доля фтора в соединении магния (MgF2) выше, чем в соединениях стронция (SrF2) и бария (BaF2), несмотря на то, что атомная масса магния меньше. Это может быть связано с другими факторами, такими как электроотрицательность ионов и стабильность соединений.
Изучение закономерностей в отношении массовой доли фтора в соединениях с двухвалентными металлами позволяет лучше понять химические свойства и взаимодействия этих элементов. Эти закономерности могут быть полезны для прогнозирования свойств новых соединений и разработки материалов с определенными химическими и физическими свойствами.
Атомные массы и массовая доля фтора: взаимосвязь

Изучение закономерностей в отношении атомных масс двухвалентных металлов к массовой доле фтора позволяет выявить интересные взаимосвязи между этими параметрами и установить закономерности в химических реакциях. Атомные массы двухвалентных металлов, таких как цинк, кадмий и свинец, имеют напрямую пропорциональную связь с массовой долей фтора в образующихся соединениях.
Сопоставив атомные массы двухвалентных металлов с их массовой долей фтора, можно выявить, что между этими параметрами наблюдается постоянное отношение. Чем выше атомная масса металла, тем больше массовая доля фтора в соединении. В периодической системе элементов это можно проследить, обратив внимание на расположение этих элементов, так как они находятся в одной группе.
Это значит, что массовая доля фтора в соединениях двухвалентных металлов можно предсказать на основе их атомных масс. Расчеты на основе этой закономерности могут быть полезными при проектировании и синтезе новых соединений, а также при определении их физико-химических свойств и применении в различных областях, включая катализ и материаловедение.
Примером применения данной взаимосвязи может быть выбор оптимального соотношения массовой доли фтора и атомных масс двухвалентного металла для получения соединения с определенными химическими и физическими свойствами. Такой подход позволяет более эффективно использовать ресурсы и снизить затраты на исследования и разработки новых материалов.
Влияние массовой доли фтора на свойства металлов

Массовая доля фтора в соединениях двухвалентных металлов играет важную роль в определении их химических и физических свойств. Фтор является самым электроотрицательным элементом и обладает высокой реакционной способностью, что влияет на взаимодействие с металлами.
Увеличение массовой доли фтора в соединениях приводит к увеличению их кислотности. Фториды двухвалентных металлов, содержащие большую массовую долю фтора, более активны в реакциях с другими веществами. Это связано с тем, что высокая электроотрицательность фтора приводит к большим изменениям зарядов на ионных растворах фторидов, усиливая их реакционную способность.
Массовая доля фтора также влияет на физические свойства металлов. Вещества с высокой массовой долей фтора обычно имеют низкую температуру плавления и кипения, что связано с прочными химическими связями между фтором и металлом. Эти связи обладают высокой прочностью, что приводит к стабильной кристаллической решетке.
Кроме того, массовая доля фтора может влиять на магнитные свойства металлов. Вещества с высокой массовой долей фтора могут обладать как ферромагнетическими, так и антиферромагнетическими свойствами, в зависимости от особенностей их кристаллической структуры и магнитного момента ионов металла.
Применение результатов исследований в промышленности

Результаты исследований, проведенных в области закономерностей массовой доли фтора в двухвалентных металлах, находят применение в различных отраслях промышленности. Одно из главных применений этой информации – разработка и производство специализированных сплавов для использования в коррозионно-устойчивых материалах.
Благодаря полученным результатам исследований, инженеры и ученые могут определить оптимальную массовую долю фтора в сплавах, что позволяет создавать материалы с максимальными характеристиками стойкости к коррозии. Это особенно актуально для производства химического оборудования, трубопроводов и емкостей, которые подвергаются воздействию агрессивных химических сред и высоких температур.
Еще одним важным применением результатов исследований является разработка специальных покрытий, имеющих улучшенную коррозионную стойкость. Нанесение таких покрытий на поверхность металлических изделий позволяет значительно продлить их срок службы и снизить затраты на ремонт и замену оборудования.
В области электроники результаты исследований находят применение при создании полупроводниковых материалов и технологий. Знание закономерностей связи массовой доли фтора с химическим составом двухвалентных металлов позволяет улучшить производительность и надежность электронных компонентов и устройств.
Также результаты исследований используются при разработке и производстве оптических материалов. Фториды двухвалентных металлов имеют важное значение для создания прозрачных и прочных материалов, используемых в оптике и лазерных технологиях. Знание закономерностей массовой доли фтора помогает улучшить качество и свойства этих материалов, что в свою очередь способствует развитию оптической и лазерной промышленности.
Вопрос-ответ

Какие металлы относятся к двухвалентным?
К двухвалентным металлам относятся металлы, которые образуют ионы с валентностью равной 2. Например, медь (Cu), цинк (Zn), кадмий (Cd) и некоторые другие.
Как связаны атомные массы двухвалентных металлов с массовой долей фтора?
Атомные массы двухвалентных металлов обратно пропорциональны их массовой доле фтора. С увеличением массовой доли фтора атомная масса металла уменьшается.
В чем заключается закономерность в отношении атомных масс двухвалентных металлов к массовой доле фтора?
Закономерность заключается в том, что при изменении массовой доли фтора у двухвалентных металлов, их атомные массы изменяются пропорционально. С ростом массовой доли фтора атомная масса металла уменьшается, и наоборот.
Как можно объяснить закономерности в отношении атомных масс двухвалентных металлов к массовой доле фтора?
Закономерности можно объяснить на основе химических реакций, которые происходят между фтором и двухвалентными металлами. Взаимодействие металла с фтором приводит к образованию ионов металла и ионов фтора. Массовая доля фтора определяет количество ионов фтора в соединении, и, следовательно, влияет на массу металла, необходимую для образования соединения. Чем выше массовая доля фтора, тем меньшая масса металла требуется. Поэтому атомные массы двухвалентных металлов обратно пропорциональны их массовой доле фтора.
Какие еще закономерности существуют в химии двухвалентных металлов?
Помимо закономерностей в отношении атомных масс двухвалентных металлов к массовой доле фтора, существуют и другие закономерности. Например, у двухвалентных металлов в соединениях с кислородом обычно валентность равна 2, а в соединениях с серой - 2 или 4, в зависимости от сероводородности окиси. Также, атомные массы двухвалентных металлов могут быть связаны с их электронной конфигурацией или положением в периодической таблице элементов.
