Металлы представляют собой группу материалов, обладающих высокой проводимостью электрического тока и тепла, а также хорошей пластичностью и прочностью. Эти свойства металлов обусловлены их особой атомной структурой.
Атомы металлов образуют решетку, которая состоит из положительно заряженных ядер атомов и свободно движущихся электронов. Электроны распределены по энергетическим уровням, и некоторые из них могут легко перемещаться по всей решетке. Это позволяет металлам быть хорошими проводниками электричества и тепла.
Основным принципом атомной структуры металлов является наличие свободных электронов, которые способны передавать энергию и совершать свободное движение вдоль кристаллической решетки. Это является основой для объяснения высокой электропроводности и теплопроводности металлов.
Еще одной важной особенностью атомной структуры металлов является их пластичность. Из-за движения свободных электронов и наличия внутренних дефектов в кристаллической решетке, металлы способны деформироваться без разрушения. Это позволяет им быть прочными и обладать высокой устойчивостью к механическим воздействиям.
Основные принципы атомной структуры металлов
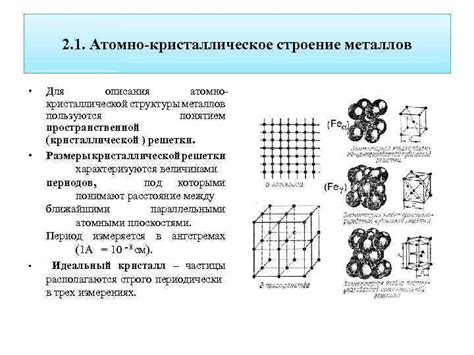
Атомная структура металлов определяет их основные свойства и поведение. Основными принципами этой структуры являются следующие:
- Металлическая связь: Атомы металлов образуют кристаллическую решетку, где положительно заряженные ядра притягивают электроны. Это создает силу связи между атомами и обеспечивает их высокую электропроводность.
- Металлическая решетка: Атомы металлов упаковываются в кристаллическую решетку, где каждый атом имеет регулярные связи с соседними атомами. Это обеспечивает высокую прочность и упругость металлов.
- Дефекты решетки: В атомной структуре металлов могут присутствовать дефекты решетки, такие как вакансии (отсутствие атома на своем месте) или дислокации (деформации решетки). Эти дефекты играют важную роль в пластичности и упрочнении металлов.
- Кристаллические границы: В металлической решетке могут быть области с различной ориентацией атомов, называемые кристаллическими границами. Они влияют на механические свойства и коррозионную стойкость металлов.
- Импуристы: В атомной структуре металлов могут присутствовать примеси других элементов, которые могут изменять их свойства. Некоторые примеси могут усиливать механические свойства, а другие могут изменять электрическую проводимость.
Понимание основных принципов атомной структуры металлов позволяет улучшить их свойства и создавать новые материалы с определенными характеристиками для различных промышленных и научных приложений.
Строение и компоненты металлических атомов

Металлические атомы представляют собой особую структуру, которая имеет ряд характерных особенностей. В отличие от неметаллических элементов, металлические атомы обладают свободно движущимися электронами во внешней энергетической оболочке, которая также называется валентной оболочкой.
Основной компонент металлических атомов - положительно заряженное ядро, которое содержит протоны и несет основную массу элемента. Вокруг ядра располагаются электроны, которые образуют электронную оболочку. Однако, у металлических атомов электроны обладают особой свойством - они не привязаны к конкретным атомам, а свободно перемещаются по всей структуре.
Благодаря этой особенности, металлы обладают рядом уникальных свойств. Свободно движущиеся электроны образуют так называемое "электронное облако", которое обеспечивает хорошую проводимость тепла и электричества. Кроме того, они способны образовывать связи с другими атомами, что позволяет металлам образовывать кристаллическую решетку с характерными свойствами.
Важно отметить, что металлическая структура может быть различной в зависимости от конкретного металла. Например, некоторые металлы образуют идеально упакованные кристаллы, а другие могут иметь более сложные структуры с дефектами и сдвигами. Кроме того, металлы могут образовывать сплавы с другими элементами, что также влияет на их структуру и свойства.
Электронная оболочка и энергетические уровни
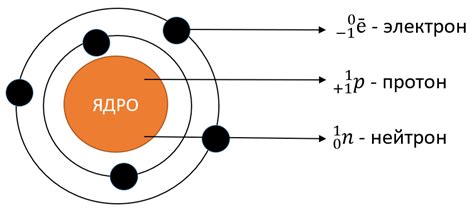
Электронная оболочка является важной составляющей атомной структуры металлов. Она состоит из электронов, которые обращаются вокруг ядра атома. Количество электронов в атоме определяется его атомным номером и равно количеству протонов в ядре. Каждый электрон занимает определенное место в электронной оболочке и обладает определенной энергией.
Атомные электроны располагаются на энергетических уровнях. Энергетический уровень — это определенная энергия, на которой могут находиться электроны атома. Энергетические уровни в атомной структуре металлов различаются, и электронам разрешено находиться только на определенных уровнях, но не между ними.
Нумерация энергетических уровней происходит от самого ближнего к ядру, который считается первым уровнем, до самого дальнего, который является последним уровнем. Каждый энергетический уровень может содержать определенное количество электронов, которое определяется формулой 2n^2, где n — номер уровня. Таким образом, на первом уровне может разместиться до 2 электронов, на втором — до 8, на третьем — до 18 и т. д.
Энергия электрона в атомной структуре металлов зависит от его расположения на энергетическом уровне. Электроны на более близких к ядру уровнях имеют меньшую энергию, а электроны на более отдаленных уровнях — большую энергию. Энергетический уровень также влияет на свойства атома и его способность участвовать в химических реакциях.
Свойства металлической атомной структуры
Металлическая атомная структура обладает рядом особых свойств, которые обуславливают ее механические, электрические и термические характеристики. Одно из главных свойств металлов - высокая проводимость электричества и тепла. Это объясняется наличием свободных электронов в атомной структуре металлов, которые могут свободно двигаться по кристаллической решетке и передавать электрический ток или тепло.
Металлические атомы могут образовывать кристаллическую решетку, которая обладает высокой механической прочностью и пластичностью. Благодаря этим свойствам металлы можно легко формовать и обрабатывать, что позволяет создавать различные изделия и конструкции из металла.
Металлическая атомная структура также обуславливает способность металлов образовывать сплавы, то есть смеси различных металлов. Это свойство позволяет изменять химические и физические свойства металла, получая материалы с улучшенными характеристиками, такие как повышенная прочность, устойчивость к коррозии и т.д.
Одной из особенностей металлической атомной структуры является наличие свободных электронов, которые обладают высокой подвижностью. Это позволяет металлам обладать способностью к электронным переходам, что является основой для работы электронных устройств и приборов.
Таким образом, свойства металлической атомной структуры, такие как высокая проводимость электричества и тепла, механическая прочность и пластичность, способность к образованию сплавов и электронным переходам, делают металлы одними из самых важных и полезных материалов в нашей жизни.
Проводимость электричества и тепла

Проводимость электричества - это способность материала передавать электрический ток. В металлах проводимость электричества обусловлена наличием свободных электронов, которые могут свободно перемещаться по структуре металла. Это объясняет почему металлы являются хорошими проводниками электричества. Свободные электроны создают электронное облако, которое позволяет передать электрический заряд от одной точки металла к другой.
Проводимость тепла в металлах связана с их кристаллической структурой. Из-за близкой упаковки атомов металлы обладают высокой плотностью и могут эффективно передавать тепловую энергию. Проводимость тепла в металлах определяется двумя факторами: теплопроводностью и тепловым сопротивлением. Теплопроводность обусловлена способностью электронов и атомов металла переносить тепловую энергию, а тепловое сопротивление - способностью материала препятствовать передаче тепла.
Проводимость электричества и тепла являются важными свойствами металлов, которые находят широкое применение в различных областях. Благодаря проводимости электричества металлы используются в электрических проводах, а проводимость тепла позволяет использовать металлы в производстве теплообменников, радиаторов и других систем охлаждения. Эти свойства металлов делают их важными материалами в инженерии и промышленности.
Пластичность и деформация металлов

Пластичность – одно из важнейших свойств металлов, обусловленное структурой и свойствами их атомов. Она представляет собой способность металла подвергаться пластической деформации без разрушения. Пластичность обусловлена способностью атомов металла смещаться друг относительно друга без меняющихся связей между ними. Результатом пластической деформации металла является изменение его формы без потери целостности.
Деформация металлов – это изменение формы и размеров металла под действием механических нагрузок. Обычно делается различие между упругой и пластической деформацией. Упругая деформация является обратимой и происходит при малых нагрузках, в результате которой металл меняет свою форму, но после снятия нагрузки возвращается к исходной форме. Пластическая деформация происходит при более высоких нагрузках и является необратимой. Пластичная деформация приводит к перераспределению атомов в металлической решетке и изменению металлических свойств.
Проведение пластической деформации металлов может осуществляться разными способами, такими как растяжение, сжатие, изгиб, скручивание и т.д. При пластической деформации изменяются межатомные расстояния и углы между атомами, что приводит к изменению металлической решетки. В результате металл становится более прочным, а его механические свойства улучшаются.
Пластичность и деформация металлов играют важную роль в различных областях промышленности и строительства. Знание законов пластичности и деформации металлов позволяет инженерам и конструкторам создавать более прочные и надежные конструкции, а также обрабатывать и формовать металлы при производстве различных изделий.
Вопрос-ответ

Каковы основные свойства атомной структуры металлов?
Основные свойства атомной структуры металлов: большая подвижность электронов внешней оболочки, образование положительно заряженных ионов и образование кристаллической решетки.
Какие принципы лежат в основе атомной структуры металлов?
Основными принципами атомной структуры металлов являются металлическая связь и образование кристаллической решетки. Металлическая связь обеспечивает свободное движение электронов внешней энергетической оболочки, создавая тем самым основу для проводимости тока и тепла. Образование кристаллической решетки позволяет атомам металла занимать определенные позиции в пространстве, образуя упорядоченную структуру.
Каково значение атомной структуры металлов для их свойств и использования в промышленности?
Атомная структура металлов имеет огромное значение для их физических и химических свойств. Например, большая подвижность электронов внешней оболочки позволяет металлам быть хорошими проводниками электричества и тепла. Образование кристаллической решетки обеспечивает металлам механическую прочность и пластичность. Благодаря этим свойствам металлы широко используются в промышленности для создания различных конструкций, инструментов, электроники и др.
