Металлы - это элементы, которые в своей атомной структуре имеют так называемую "металлическую связь". Одной из особенностей этой связи является способность атомов металлов отдавать свои электроны, что делает их проводниками электричества и тепла.
Некоторые металлы, такие как натрий, калий и цезий, легко отдают свои электроны, образуя положительно заряженные ионы. Это объясняется их низкой ионизационной энергией, то есть энергией, необходимой для отрыва электрона от атома. Такие металлы продолжают отдавать свои электроны при взаимодействии с другими элементами, образуя ионы, которые обладают положительным зарядом.
Однако, не все металлы способны легко отдавать свои электроны. Некоторые, например, железо или алюминий, имеют высокую ионизационную энергию и не отдают электроны с такой легкостью, как щелочные металлы. Тем не менее, в определенных условиях эти металлы также могут образовывать положительно заряженные ионы.
Способность металлов отдавать электроны очень важна в таких процессах, как электролиз или гальваническая коррозия, где происходит перенос электронов от одного металла к другому. Понимание этой способности позволяет улучшить технологии производства, разработать новые материалы и использовать металлы в различных сферах науки и промышленности.
Металлы: особенности связи и строения

Металлы - это группа элементов, которые обладают способностью образовывать идеальную кристаллическую решетку. Основной особенностью связи в металлах является взаимодействие между положительно заряженными ионами металла и свободными электронами. В результате такой связи металлическая решетка образует электронное облако, которое даёт металлу его уникальные свойства.
Строение металлов характеризуется наличием кристаллической решетки, в которой ионы металла упорядочено и расположены в определенном порядке. Ионы металла составляют симметричную кристаллическую структуру, где каждый ион окружен несколькими соседними ионами. Эта упорядоченная структура позволяет металлам обладать высокой прочностью и эластичностью.
Металлические связи характеризуются высокой электропроводностью и теплопроводностью, что делает металлы идеальными материалами для проводов и теплообменников. Они также обладают хорошей пластичностью и способностью к деформации без разрушения, что позволяет им быть использованными для создания различных конструкций.
Некоторые металлы, такие как щелочные и щелочноземельные, обладают свойством отдавать свои электроны. Это связано с низкой энергией ионизации у данных элементов. Электроны, отданные металлом, могут быть использованы другими элементами для образования химических связей или для проведения электрического тока.
Вот некоторые примеры металлов, способных отдавать свои электроны:
- Литий
- Натрий
- Калий
- Магний
- Кальций
Эти металлы имеют низкую энергию ионизации и легко отдают свои электроны, что делает их активными элементами в химических реакциях и электронных системах.
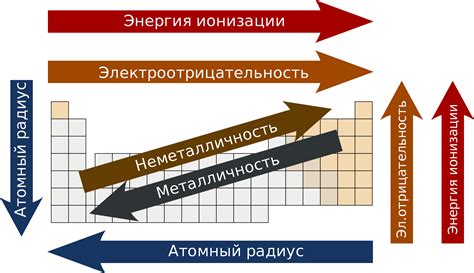
Отношение элементов к магнитизму и электроотрицательности
Магнитизм
Магнитизм - это физическое явление, связанное с наличием и движением магнитных полей. Некоторые элементы обладают свойством быть магнитными и притягивать или отталкивать другие магнитные материалы. Такие элементы называются магнетиками.
Магнетики могут быть разделены на две категории: магнетики первого и второго рода. Магнетики первого рода являются непостоянными и теряют свою магнитную силу при удалении внешнего магнитного поля. К ним относятся железо, никель и кобальт. Магнетики второго рода, напротив, являются постоянными магнетиками и сохраняют свою магнитную силу даже после удаления внешнего магнитного поля. К ним относятся редкие земли, такие как неодим, самарий и др.
Электроотрицательность
Электроотрицательность - это химическая величина, которая описывает способность атома притягивать электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны к себе.
Электроотрицательность элемента влияет на его химические свойства, такие как способность образовывать ионные связи, кислотность или основность соединений. Элементы с высокой электроотрицательностью, такие как кислород и фтор, обычно образуют ионные соединения и обладают кислотными свойствами. Элементы с низкой электроотрицательностью, например, натрий и калий, обычно образуют ионные соединения и обладают основными свойствами.
Важно отметить, что электроотрицательность элемента также связана с его положением в периодической таблице. В верхней правой части таблицы находятся элементы с самой высокой электроотрицательностью, а в нижней левой части - с самой низкой электроотрицательностью.
Механизм отдачи электронов атомами металлов
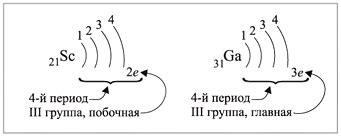
Атомы металлов могут отдавать свои электроны благодаря специальному механизму, называемому ионизацией. Ионизация является процессом, при котором электрон отделяется от атома и становится свободным.
При отдаче электрона атомом металла, сначала происходит образование ионного радикала. Это происходит путем передачи электрона от атома металла к атомной решетке. Атомная решетка, в свою очередь, становится заряженной и образует положительный ион.
Механизм отдачи электронов атомами металлов обусловлен их особенностями строения. Атомы металлов имеют низкую электронную аффинность, что означает, что у них мало энергии, необходимой для отдачи электрона. Кроме того, атомы металлов имеют малое количество электронов в валентной оболочке, что способствует их склонности к отдаче электронов.
Процесс отдачи электронов атомами металлов играет важную роль в химических реакциях и связан с такими явлениями, как ионизация, окисление и редукция. Это позволяет атомам металлов образовывать ионы положительного заряда, которые обладают специфическими свойствами и могут участвовать в различных процессах и реакциях.
Вопрос-ответ

Какие металлы могут отдавать свои электроны?
Многие металлы способны отдавать свои электроны. Например, щелочные металлы, такие как натрий и калий, легко отдают свои электроны, чтобы образовать положительные ионы. Также это касается некоторых металлов переходных элементов, таких как железо и медь.
Почему металлы могут отдавать свои электроны?
Металлы могут отдавать свои электроны из-за особенностей строения атома. В атоме металла один или несколько электронов находятся в свободной зоне, которая называется проводимостью. Эти электроны могут легко двигаться по металлической решетке и передаваться другим атомам.
Каким образом происходит отдача электронов металлами?
Отдача электронов металлами происходит путем ионизации. При взаимодействии металлического атома с другим веществом, атом металла отдает один или несколько электронов, становясь положительно заряженным ионом. Этот процесс позволяет металлам участвовать в различных химических реакциях и образовывать соединения с другими элементами.
Какие металлы отдают свои электроны с большей легкостью?
Металлы отдают свои электроны с разной легкостью в зависимости от их электроотрицательности. Чем ниже электроотрицательность металла, тем легче ему отдавать электроны. Например, щелочные металлы, такие как литий или калий, имеют очень низкую электроотрицательность и легко отдают свои электроны, в то время как металлы переходных элементов, такие как железо или медь, имеют более высокую электроотрицательность и отдают свои электроны с некоторыми сложностями.
