Щелочными металлами называют элементы I группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы отличаются высокой реакционной способностью и химической активностью, так как их электронная конфигурация обеспечивает наличие одного электрона в валентной оболочке.
Электронная конфигурация иона щелочного металла определяется их химической активностью и взаимодействием с другими элементами. Щелочные металлы имеют тенденцию отдавать один электрон, образуя ионы положительной заряды (катионы). Так, ионы лития имеют конфигурацию 2s0, ион натрия - 2p6, ион калия - 3s0, ион рубидия - 3p6, ион цезия - 4s0, и ион франция - 4p6. Это означает, что все ионы щелочных металлов имеют полностью заполненную внутреннюю оболочку и один электрон в валентной оболочке.
Электронная конфигурация иона щелочного металла играет важную роль в химической реактивности этих элементов. Одноположительно заряженные катионы щелочных металлов обладают высокой активностью и реагируют с различными веществами, образуя стабильные соединения. Электронная конфигурация валентной оболочки обуславливает химическую активность ионов щелочных металлов и их способность образовывать ионо-молекулярные соединения.
Что такое электронная конфигурация?
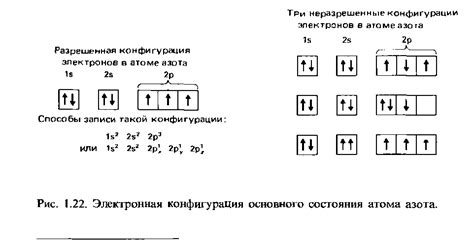
Электронная конфигурация – это распределение электронов в энергетических уровнях и подуровнях оболочек атома или иона. Она определяет, как электроны размещаются вокруг ядра атома и какие зоны внутри атома они заполняют.
Электронная конфигурация включает информацию о количестве электронов в каждом энергетическом уровне и подуровне. Она записывается в виде чисел и символов, с помощью которых указываются энергетические уровни (n), а также подуровни (s, p, d, f). Например, электронная конфигурация атома водорода будет записываться как 1s1.
Конфигурация электронов определяет множество химических и физических свойств атома или иона. Она указывает на склонности атома образовывать химические связи, его реактивность и его расположение в периодической системе элементов. Например, щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), имеют общую электронную конфигурацию внешней оболочки ns1, что делает их очень реактивными.
Понимание электронной конфигурации является важным для изучения химической связи, реакций и химических свойств элементов. Она помогает ученым и химикам предсказывать и понимать, как соединения образуются и взаимодействуют друг с другом.
Значение электронной конфигурации

Электронная конфигурация иона щелочного металла определяет количество электронов на его энергетических оболочках. Эта информация позволяет определить химические свойства ионов и их способность образовывать соединения.
Электронная конфигурация иона указывает на его возможности для образования химических связей и взаимодействия с другими элементами. Например, электроны на внешней оболочке ионы щелочного металла обладают слабым удержанием ядра, что делает ионы легко реагирующими и способными образовывать ионные связи с отрицательно заряженными атомами или группами атомов.
Электронная конфигурация иона также определяет его размер и электронную структуру, что влияет на его физические свойства, такие как плавление и кипение. Чем больше количество электронов на внешней оболочке, тем больше размер иона и тем выше его температура плавления и кипения.
Знание электронной конфигурации ионов щелочных металлов играет важную роль в химии и материаловедении. Оно помогает понять, как происходят химические реакции и каким образом можно управлять свойствами материалов путем изменения состава ионов. Изучение электронных структур ионов щелочных металлов является фундаментальным шагом в понимании химического поведения иона и его влияния на окружающую среду.
Ионы щелочных металлов

Щелочные металлы - группа элементов, относящихся к первой группе периодической системы. Их ионы имеют особенности в электронной конфигурации, которые определяют их химические свойства и способность образовывать ионы.
Электронная конфигурация ионов щелочных металлов характеризуется утратой одного электрона из внешнего s-орбиталя. Например, ион лития имеет конфигурацию [He] 2s1, ион натрия - [Ne] 3s1, ион калия - [Ar] 4s1.
Утрата одного электрона приводит к образованию положительного иона, который имеет положительный заряд, равный числу утраченных электронов. Так, ион лития имеет заряд +1, ион натрия - +1, ион калия - +1.
Электронное строение ионов щелочных металлов определяет их химическую реакционность. Ионы щелочных металлов характеризуются высокой активностью, так как внешний электрон находится на достаточно большом расстоянии от ядра и слабо связан с ним. Это делает ионы щелочных металлов легко доступными для образования химических связей с другими элементами.
Ионы щелочных металлов обладают рядом химических свойств, обусловленных их электронной конфигурацией. Они способны легко образовывать соединения со многими элементами, образуя ионы различных зарядов и обладающие разнообразными свойствами.
Химические свойства

Щелочные металлы обладают высокой химической активностью и свойством образовывать ионы с положительным зарядом путем потери одного электрона из внешней оболочки. Это обусловлено их низкой энергией ионизации и большим радиусом атомов.
Ионы щелочных металлов обладают мощными окислительными свойствами и легко взаимодействуют с веществами, образуя соединения. Они реагируют даже с воздухом и водой, поэтому хранятся под слоем специального инертного вещества.
Щелочные металлы обладают сильной щелочной реакцией при растворении в воде. В результате этого образуются гидроксиды – сильные основания. Например, растворенный натрий образует натриевую щелочь, а растворенный калий – калиевую щелочь.
Одной из характерных особенностей щелочных металлов является их способность образовывать амфотерные соединения, то есть способность вести себя и как основание, и как кислота. Такое поведение обусловлено наличием элементов во второй и третьей периодических группах, которые могут образовывать сложные ионы и соединения с различными кислотами и основаниями.
Щелочные металлы часто используются в различных отраслях промышленности, в лабораторных исследованиях и в повседневной жизни. Они применяются для производства щелочных батарей, стекла, мыла, удобрений и других продуктов. Кроме того, ионы щелочных металлов используются в различных фототехнических процессах и оптике, благодаря их способности обладать хорошей излучательной и люминесцентной активностью.
Понятие о щелочных металлах

Щелочные металлы - это класс элементов, относящихся к первой группе периодической системы элементов. Главной особенностью щелочных металлов является их высокая активность, обусловленная наличием одного электрона в внешней электронной оболочке.
Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все они обладают низкой плотностью, мягкостью и низкой температурой плавления. Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы с щелочной реакцией.
Щелочные металлы хорошо взаимодействуют с кислородом, образуя оксиды, а также с водородом, образуя гидриды. Они реагируют с неметаллами, образуя соли и с щелочными металлами, образуя сплавы.
Электронная конфигурация ионов щелочных металлов имеет особенности. При потере внешнего электрона щелочные металлы образуют положительно заряженные ионы с 1+ зарядом. Например, ион лития будет иметь электронную конфигурацию [He] 2s1.
Щелочные металлы широко используются в промышленности и в научных исследованиях. Они находят применение в производстве щелочных батарей, сплавов и легированных материалов, а также в области катализа и синтеза органических соединений.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и характеризуются высокой реактивностью.
Одно из основных химических свойств щелочных металлов - их способность образовывать ионы, теряя одну внешнюю электронную оболочку. Это связано с тем, что у них только один электрон в валентной оболочке, который легко отдаётся. Ионы щелочных металлов обладают положительным зарядом и образуют стабильные соединения с отрицательно заряженными ионами других элементов.
Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Это реакция активной металлической поверхности с водой:
2M + 2H2O → 2MOH + H2
Щелочные металлы также реагируют с кислородом, образуя оксиды. Например, литий при нагревании с кислородом образует оксид лития:
4Li + O2 → 2Li2O
Щелочные металлы также способны образовывать множество солей, кислоты и различные соединения с другими элементами. Они широко используются в промышленности, медицине, сельском хозяйстве и других областях благодаря своим уникальным химическим свойствам и возможностям реакций.
Почему электронная конфигурация важна?

Электронная конфигурация - это распределение электронов в атоме или ионе, описывающее уровни и подуровни их энергетического состояния. Она играет важную роль в определении химических и физических свойств вещества и его взаимодействия с другими веществами. Вот почему электронная конфигурация является ключевым понятием в химии и физике.
Во-первых, электронная конфигурация определяет количество и распределение электронов в атоме или ионе. Это влияет на химическую активность вещества. Например, щелочные металлы имеют один электрон на внешнем энергетическом уровне, что делает их очень реактивными. Они легко отдают этот электрон и образуют положительный ион, что является одной из основных характеристик щелочных металлов.
Во-вторых, электронная конфигурация определяет энергетические уровни, на которых находятся электроны. Это влияет на способность атома или иона создавать или принимать электроны во время химических реакций. Например, электронная конфигурация железа определяет его способность принять два электрона и образовать ион с зарядом Fe2+. Это позволяет железу образовывать соединения с другими веществами, такими как кислород, и создавать разнообразные соединения и соединения с различными свойствами.
В-третьих, электронная конфигурация определяет структуру молекулы. Например, электронная конфигурация воды, H2O, обуславливает ее угловую форму и полярность, что делает ее очень растворимой в воде. Это свойство имеет фундаментальное значение для жизни на Земле, так как вода является основным раствором, в котором происходят многие биологические процессы.
В заключение, электронная конфигурация важна, потому что она определяет химические и физические свойства вещества, его взаимодействие с другими веществами и структуру молекулы. Понимание электронной конфигурации помогает предсказывать и объяснять свойства различных веществ, а также разрабатывать различные химические и физические процессы.
Примеры электронной конфигурации щелочных металлов
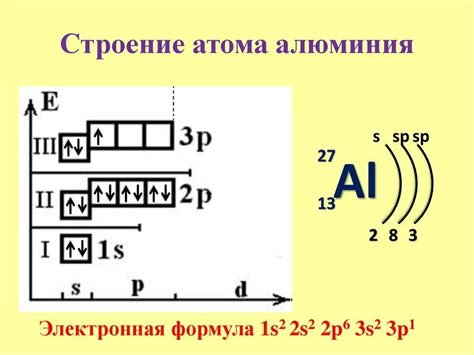
Щелочные металлы - это элементы первой группы периодической системы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Также часто учитываются группы 3 и 4 периода, включая элементы рубидий и цезий. Эти металлы отличаются от других элементов тем, что они имеют только одну электронную оболочку.
Электронная конфигурация щелочных металлов может быть представлена в следующем виде:
- Литий (Li): 1s2 2s1
- Натрий (Na): 1s2 2s2 2p6 3s1
- Калий (K): 1s2 2s2 2p6 3s2 3p6 4s1
- Рубидий (Rb): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
- Цезий (Cs): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1
- Франций (Fr): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1
Как видно из этих примеров, щелочные металлы имеют общую тренденцию в электронной конфигурации: они имеют один электрон во внешней электронной оболочке (s-орбитали). Это делает их очень реактивными и способными образовывать ионы с положительным зарядом.
Что такое ионы щелочных металлов?
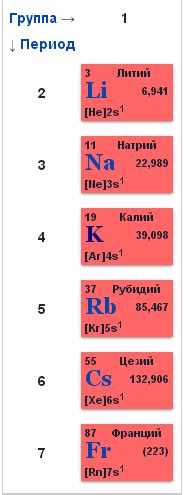
Ионы щелочных металлов - это положительно заряженные атомы, образованные электронными переходами во внешней оболочке атомов щелочных металлов. Щелочные металлы включают элементы группы 1 периодической таблицы - литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Ионы щелочных металлов имеют положительный заряд, поскольку они теряют один электрон из внешней оболочки для образования стабильной конфигурации. Это происходит при взаимодействии атомов щелочных металлов с другими атомами или молекулами в процессе химических реакций.
Ионы щелочных металлов обладают высокой реактивностью и химической активностью. Это связано с тем, что у них только один электрон во внешней оболочке, который легко отделяется и участвует в химических связях. Это делает ионы щелочных металлов хорошими ионами для формирования солей и ослабления кислых свойств веществ.
Ионы щелочных металлов имеют важное значение для многих процессов в природе и технологии. Например, ионы натрия используются в процессе обмена ионами для очистки воды, а ионы калия необходимы для нормального функционирования клеток в организмах живых существ.
Реактивность ионов щелочных металлов

Щелочные металлы относятся к группе элементов, которые характеризуются высокой реактивностью. Ионы щелочных металлов, такие как ионы натрия (Na+), калия (K+) и лития (Li+), проявляют особую активность в химических реакциях. Это связано с их электронной конфигурацией и особенностями взаимодействия с другими веществами.
Реактивность ионов щелочных металлов определяется их способностью образовывать стабильные соединения с другими элементами. Эти ионы обладают сильным желанием отдать свой один электрон во внешней оболочке и достичь стабильной электронной конфигурации благодаря образованию ионов с положительным зарядом.
Процесс образования иона щелочного металла сопровождается выделением энергии, что делает его реактивным и способным вступать в химические реакции с другими веществами. Ионы щелочных металлов легко реагируют с водой, кислородом, галогенами и другими химическими элементами, образуя различные соединения.
При взаимодействии ионов щелочных металлов с водой происходит химическая реакция, которая сопровождается выделением водорода и образованием гидроксидов. Так, ион натрия реагирует с водой, образуя сильную щелочь натриевый гидроксид (NaOH), а ион калия образует калиевый гидроксид (KOH).
Ионы щелочных металлов также реагируют с кислородом, образуя оксиды. Например, ион калия образует оксид калия (K2O), а ион натрия образует оксид натрия (Na2O). Эти соединения обладают особыми свойствами и находят широкое применение в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Чем отличается электронная конфигурация атома от электронной конфигурации иона щелочного металла?
Электронная конфигурация атома указывает, как распределены электроны по энергетическим уровням в нейтральном атоме. Электронная конфигурация иона щелочного металла указывает, как распределены электроны по энергетическим уровням в ионе, который образуется после потери или приобретения одного или нескольких электронов.
Какая электронная конфигурация у иона щелочного металла, образовавшегося после потери одного электрона?
У иона щелочного металла, образовавшегося после потери одного электрона, электронная конфигурация будет иметь одно электронное зарядовое поле меньше, чем у соответствующего нейтрального атома. Например, у иона натрия (Na+) электронная конфигурация будет 1s2 2s2 2p6.
Какая электронная конфигурация у иона щелочного металла, образовавшегося после приобретения одного электрона?
У иона щелочного металла, образовавшегося после приобретения одного электрона, электронная конфигурация будет иметь одно электронное зарядовое поле больше, чем у соответствующего нейтрального атома. Например, у иона лития (Li-) электронная конфигурация будет 1s2 2s2 2p6 3s2.
Как меняется электронная конфигурация иона, если он образуется после потери двух электронов?
Если ион щелочного металла образуется после потери двух электронов, его электронная конфигурация будет иметь два электронных зарядовых поля меньше, чем у соответствующего нейтрального атома. Например, у иона магния (Mg2+) электронная конфигурация будет 1s2 2s2.
Как меняется электронная конфигурация иона, если он образуется после приобретения двух электронов?
Если ион щелочного металла образуется после приобретения двух электронов, его электронная конфигурация будет иметь два электронных зарядовых поля больше, чем у соответствующего нейтрального атома. Например, у иона кислорода (O2-) электронная конфигурация будет 1s2 2s2 2p6 3s2 3p6.
