Электронная формула атома металла – это уникальное представление о распределении электронов в его электронной оболочке. Электронная формула позволяет понять, каким образом электроны занимают энергетические уровни и орбитали атома металла, и какие у них энергии.
Наиболее типичный металл – это элемент с характерными металлическими свойствами, такими как хорошая электропроводность, теплопроводность и пластичность. В периодической системе элементов наиболее типичными металлами являются элементы на левой половине таблицы, такие как железо, медь, алюминий и другие.
Электронная формула атома металла состоит из символов элементов и нижних индексов, отражающих количество электронов на каждом энергетическом уровне. Например, для наиболее распространенного металла – железа – электронная формула будет выглядеть как 1s2 2s2 2p6 3s2 3p6 4s2 3d6. У этого атома железа 26 электронов, распределенных по различным энергетическим уровням и орбиталям.
Строение атома металла
Атом наиболее типичного металла состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны. Протоны обладают положительным зарядом, а нейтроны не имеют заряда. Число протонов в ядре определяет химические свойства элемента и называется атомным номером.
Электронная оболочка атома металла представляет собой зону, в которой движутся электроны. Электронов может быть несколько уровней, каждый из которых имеет свою энергию. Ближайший к ядру уровень оболочки имеет наибольшую энергию, а самый дальний – наименьшую. Протоны и электроны притягиваются друг к другу электростатической силой.
При взаимодействии с другими атомами металлы обычно отдают свои электроны, образуя положительные ионы. Это связано с их низкой энергией электронов, что позволяет им легко вступать в химические реакции. Отдавая электроны, металлы достигают стабильного состояния, когда их внешний энергетический уровень становится полностью заполненным.
Строение атома металла является основой для объяснения множества свойств и поведения металлов. Это также позволяет понять причины их высокой электропроводности, теплопроводности и пластичности. Изучение строения атома металла имеет важное значение для разработки новых материалов и технологий.
Протоны и нейтроны
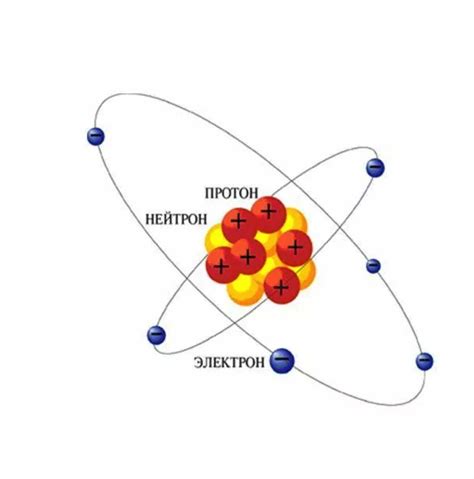
Протоны - это элементарные частицы, которые составляют ядро атома. Они имеют положительный электрический заряд, равный единице заряда элементарного заряда. Протоны являются стабильными и не распадаются. Их масса составляет около 1836 масс электрона.
Нейтроны - это также элементарные частицы, которые составляют ядро атома. Они не имеют электрического заряда и нейтральны. Нейтроны являются стабильными и не распадаются. Их масса также составляет около 1836 масс электрона.
В ядре атома наиболее типичного металла обычно содержатся как протоны, так и нейтроны. Количество протонов в ядре определяет химические свойства атома и его положение в периодической таблице элементов. Нейтроны в ядре обеспечивают стабильность и энергетическую устойчивость атома.
Протоны и нейтроны взаимодействуют друг с другом с помощью притяжения сильного ядерного взаимодействия. Они также взаимодействуют с электронами, которые обращаются по определенным энергетическим уровням вокруг ядра.
В периодической таблице элементов протоны и нейтроны обозначаются числом в верхнем индексе и нижнем индексе соответственно. Например, для атома углерода, который имеет 6 протонов и 6 нейтронов, его ядро обозначается как ^12C, где ^12 - обозначение массового числа, а С - символ химического элемента.
Электроны и их орбитали
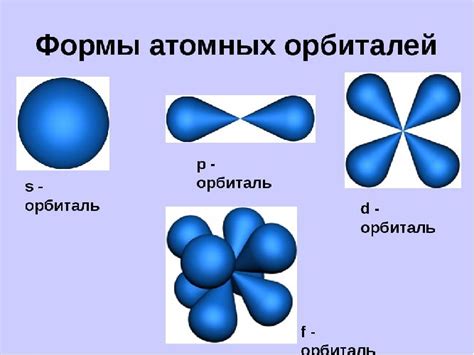
Атом наиболее типичного металла имеет сложную структуру, состоящую из электронов и их орбиталей. Электроны - это негативно заряженные частицы, которые обращаются вокруг ядра атома. Они обладают массой, но их размер по сравнению с ядром атома очень мал. Орбитали - это области пространства, в которых электроны могут находиться и двигаться.
Каждая орбиталь может содержать определенное количество электронов. На самом нижнем энергетическом уровне (K-уровне) находится 2 электрона. На следующем уровне (L-уровне) может находиться до 8 электронов. А на самом высоком уровне (M-уровне) может находиться до 18 электронов. Это называется правилом Хунда, которое позволяет определить расположение электронов на орбиталях.
Каждая орбиталь имеет свойственную форму или геометрическую структуру. Некоторые орбитали имеют форму сферы (s-орбитали), другие имеют форму двойной гребенки (p-орбитали), а еще другие имеют более сложную форму (d-орбитали). Каждая орбиталь может иметь разное число электронов в зависимости от своей формы и энергии.
Внешняя электронная оболочка
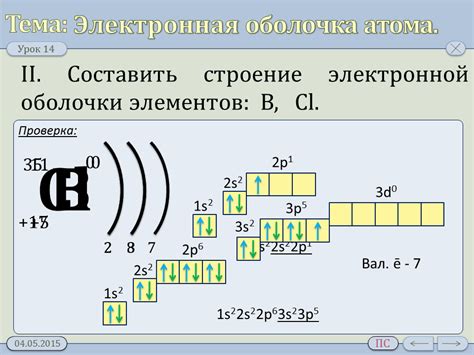
Внешняя электронная оболочка атома представляет собой наружный слой электронов, который находится на большом расстоянии от ядра. Эти электроны играют важную роль в химических реакциях и определяют химические свойства металлов.
Обычно внешняя оболочка металла содержит один или несколько электронов. Общее количество электронов в этой оболочке определяет его положение в периодической таблице элементов. Например, у металлов, которые находятся в первом периоде, внешняя оболочка содержит 1 электрон, а у металлов во втором периоде – 2 электрона.
Внешние электроны обладают особыми свойствами. Они легко участвуют в химических реакциях, образуя ионы или соединения с другими элементами. Металлы, имеющие 1 или 2 внешних электрона, имеют особую склонность отдавать их другим элементам, что делает их хорошими электронными донорами.
Внешняя электронная оболочка металлов влияет на их физические и химические свойства. Например, металлы с полностью заполненными внешними оболочками обычно обладают высокой стабильностью и низкой активностью в химических реакциях. С другой стороны, металлы с неполностью заполненными внешними оболочками часто образуют разнообразные соединения и проявляют высокую активность.
Роль внешних электронов
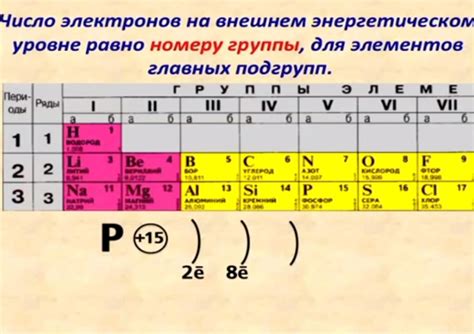
Внешние электроны играют ключевую роль в химическом поведении атомов. Они находятся на самом удаленном от ядра энергетическом уровне и определяют химические свойства атомов.
При взаимодействии атомов в химических реакциях внешние электроны могут быть переданы, приняты или разделены между атомами. Это позволяет образовывать связи между атомами, образуя структуру соединений.
Внешние электроны также определяют реакционную способность атомов. Число внешних электронов (валентных электронов) обычно равно номеру главной группы, к которой принадлежит атом в периодической системе элементов.
Наличие непарных внешних электронов делает атом или ион нестабильными и способными к реакциям. Например, металлы, имеющие только одного или двух валентных электрона на внешнем энергетическом уровне, легко отдают эти электроны и образуют положительные ионы, что делает их металлическими. Наоборот, неметаллы, имеющие несколько непарных внешних электронов, могут принять электроны от других атомов и образовывать отрицательные ионы.
Таблица Менделеева позволяет систематизировать элементы в соответствии с количеством и расположением их внешних электронов, что полезно для изучения и понимания химических свойств различных элементов.
Как определить число валентных электронов?

Для определения числа валентных электронов в атоме наиболее типичного металла необходимо учитывать его электронную конфигурацию. Валентными электронами называются электроны, находящиеся на наружных энергетических уровнях атома, которые определяют его химические свойства.
Чтобы найти число валентных электронов, можно использовать таблицу Менделеева. В ней указана электронная конфигурация атомов различных элементов. Валентные электроны обозначаются как s, p, d или f и имеют определенное количество. Например, в основном состоянии атома натрия (Na) электронная конфигурация будет 1s^22s^22p^63s^1. Из нее видно, что наружный энергетический уровень атома натрия содержит один электрон, поэтому атом натрия имеет один валентный электрон.
Также можно использовать правило октета, которое гласит, что атом стремится иметь 8 валентных электронов на своем наружном энергетическом уровне, чтобы достичь стабильности, подобной эдельгейновой газовой конфигурации. Например, у атома кислорода (O) электронная конфигурация в основном состоянии будет 1s^22s^22p^4. Он имеет 6 валентных электронов и стремится к 8, поэтому образует две ковалентные связи с другими атомами, чтобы добиться октета.
В целом, определение числа валентных электронов в атоме металла позволяет предсказать его реакционную способность и тип химической связи, которую он может образовать. Зная число валентных электронов, можно более точно предсказать его взаимодействие с другими атомами и молекулами.
Вопрос-ответ

Какие элементы входят в состав электронной формулы атома наиболее типичного металла?
В состав электронной формулы атома наиболее типичного металла входят две части: ядро атома и облако электронов. Ядро состоит из протонов и нейтронов, а облако электронов состоит из электронов. Большинство металлов находится в группе 1-2 периодической системы элементов и имеют общую электронную формулу s-слоя nl. Так, например, электронная формула атома натрия (Na) будет иметь вид 1s^2 2s^2 2p^6 3s^1. Она показывает, что у атома натрия есть 11 электронов и они распределены по различным энергетическим слоям и подуровням.
Каким образом электронная формула атома наиболее типичного металла отличается от электронной формулы атома водорода?
Электронная формула атома наиболее типичного металла отличается от электронной формулы атома водорода своей структурой. В электронной формуле атома водорода только один электрон располагается на первом энергетическом уровне (s-слое), обозначается 1s^1. В то же время, электронная формула атома наиболее типичного металла будет состоять из нескольких слоев и подуровней. Для примера рассмотрим электронную формулу атома натрия (Na), которая будет иметь вид 1s^2 2s^2 2p^6 3s^1. Здесь на первом энергетическом уровне располагаются два электрона, на втором - восемь электронов, и на третьем - один электрон.
