Электронная конфигурация атома обозначает распределение электронов по энергетическим уровням и субуровням. Она играет важную роль в определении химических свойств элемента, в том числе его активности. Один из самых активных металлов в периодической таблице – это атом, находящийся в первой группе, а именно, на первом энергетическом уровне.
Существует два возможных варианта электронной конфигурации атома данного металла: 3s23p1 и 3s2 3s1 3s23p2. Оба варианта описывают систему электронных оболочек атома, но могут отличаться последовательностью заполнения энергетических уровней и субуровней.
Первый вариант электронной конфигурации 3s23p1 означает, что на третьем энергетическом уровне находятся 2 электрона на s-субуровне и 1 электрон на p-субуровне. Такая конфигурация характерна для одного из элементов первой группы периодической таблицы.
Второй вариант, 3s2 3s1 3s23p2, указывает на то, что на первом энергетическом уровне находятся 2 электрона, на втором – 1 электрон, а на третьем энергетическом уровне – 2 электрона на s-субуровне и 2 электрона на p-субуровне.
Для определения наиболее точной электронной конфигурации атома данного металла, требуется знание его атомного номера, который отвечает за количество электронов в атоме. На основе этого числа можно точно определить распределение электронов по энергетическим уровням и субуровням.
Электронная конфигурация атома наиболее активного металла

Атом наиболее активного металла имеет электронную конфигурацию, которая определяет его химические свойства и реакционную способность.
Наиболее активные металлы находятся в группе 1 периодической системы элементов. В данной группе находятся алкалиметаллы, такие как литий (Li), натрий (Na), калий (K) и другие.
Электронная конфигурация атома наиболее активного металла может быть представлена различными способами, включая упорядоченное расположение электронов в энергетических уровнях и подуровнях.
Одной из возможных электронных конфигураций для наиболее активного металла может быть 3s2 3p1 или 3s23p2, что означает, что на третьем энергетическом уровне находятся 2 электрона в подуровне s и 1 электрон в подуровне p.
Такая электронная конфигурация позволяет атому наиболее активного металла легко отдавать 1 электрон из своей внешней энергетической оболочки, что является характерной особенностью активных металлов.
Именно благодаря этой особенности наиболее активные металлы проявляют сильную реакционную способность и образуют химические соединения с другими элементами.
Электронная конфигурация атома
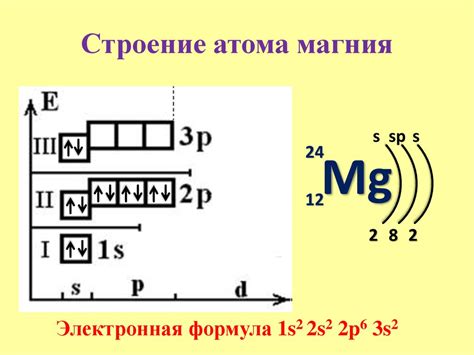
Электронная конфигурация атома определяет расположение электронов в его электронных оболочках. Каждый атом имеет свою характеристическую электронную конфигурацию, которая определяется его порядковым числом и группой в таблице периодических элементов.
Например, для атома наиболее активного металла, электронная конфигурация может быть представлена в виде 3s23p1 или 3s2 3s1 3s23p2, в зависимости от того, какими подуровнями заполнены электронные оболочки. Здесь цифры 3 и s обозначают главное квантовое число и подуровень s, а цифра 2 или 1 - количество электронов на данном подуровне.
Электронная конфигурация атома наиболее активного металла может изменяться в зависимости от его окружения и условий. Однако, обычно атом наиболее активного металла имеет внешнюю электронную оболочку, заполненную не полностью, что делает его реактивным и способным образовывать соединения с другими атомами.
Электронная конфигурация атома обуславливает его химические свойства и способность образовывать ионные соединения. Атомы наиболее активных металлов, как правило, имеют один или два свободных электрона на внешней электронной оболочке, что делает их способными легко потерять эти электроны и образовать положительные ионы.
Изучение электронной конфигурации атома наиболее активного металла важно для понимания его физических и химических свойств, а также для прогнозирования его поведения в различных химических реакциях и процессах.
Наиболее активный металл

Наиболее активный металл – химический элемент, обладающий высокой реактивностью и способностью легко образовывать соединения с другими элементами. Обычно такие металлы находятся в группе 1 (IА) периодической системы элементов, называемой щелочными металлами.
Один из самых известных наиболее активных металлов - это литий (Li). Этот элемент имеет электронную конфигурацию 1s2 2s1. Литий легко реагирует с водой, образуя водород и щелочной гидроксид. Кроме того, литий может вступать в реакции с кислородом и образовывать соединения, которые используются в производстве литиевых батарей.
Другим примером наиболее активного металла является калий (K), с электронной конфигурацией 1s2 2s2 2p6 3s2 3p6 4s1. Калий также реагирует с водой, выделяясь водородом и образуя щелочную гидроксид. Кроме того, калий является важным элементом, используемым в производстве удобрений, огнеупорных материалов и других химических соединений.
Важно отметить, что электронная конфигурация атома наиболее активного металла может быть представлена различными способами. Например, атом кальция (Ca) может иметь электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 или 1s2 2s2 2p6 3s2 3p6 4s1 3d1, в зависимости от дополнительной степени раздела электронных орбиталей. В обоих случаях кальций является реактивным металлом, способным образовывать соединения с другими элементами.
Электронная конфигурация атома наиболее активного металла: 3s23p1

Электронная конфигурация атома наиболее активного металла указывает на расположение его электронов в энергетических уровнях и подуровнях. В данном случае, конфигурация 3s23p1 означает, что энергетические уровни 3s и 3p заполнены электронами, и на последнем подуровне 3p имеется один электрон.
Атомы этого металла обладают сильной склонностью отдавать свой последний электрон для образования положительного иона. Такие металлы обычно являются очень реактивными и способны проводить электрический ток. Добавление электрона к атому данного металла приведет к изменению его электронной конфигурации и образованию отрицательного иона.
Целая система периодического закона Менделеева строится на основе электронной конфигурации атомов элементов. Этот параметр позволяет предсказывать различные свойства элементов, такие как активность, расположение в таблице, химическую реактивность и другие. Поэтому, знание электронной конфигурации наиболее активного металла играет важную роль в понимании его химии и поведения в химических реакциях.
Электронная конфигурация атома наиболее активного металла: 3s2 3s1 3s23p2

Электронная конфигурация атома наиболее активного металла может быть представлена как 3s2 3s1 3s23p2. Это означает, что в атоме этого металла первые два электрона находятся в подуровне 3s, следующий электрон занимает другую подоболочку 3s, и четыре последних электрона расположены в подуровне 3p.
Такая электронная конфигурация говорит о наличии трех электронов в внешней электронной оболочке атома металла. Это делает этот металл очень реакционноспособным, так как он старается отдать или принять один или несколько электронов, чтобы достичь стабильной конфигурации атома.
Электронная конфигурация 3s2 3s1 3s23p2 также указывает на наличие двух электронов в подуровне 3s, что делает этот металл алкалийским. Алкалийские металлы обладают высокой активностью, так как они легко отдают один электрон, чтобы достигнуть стабильной октетной конфигурации.
Сочетание этих электронных конфигураций говорит о потенциальной активности и реакционности атома этого металла. Электроны в подуровне 3s могут быть легко отданы или приняты для образования ионов, а электроны в подуровне 3p могут участвовать в химических реакциях с другими веществами. Это делает этот металл одним из наиболее активных металлов, способных образовывать соединения с другими элементами и проводить электрический ток.
Сравнение 3s23p1 и 3s2 3s1 3s23p2
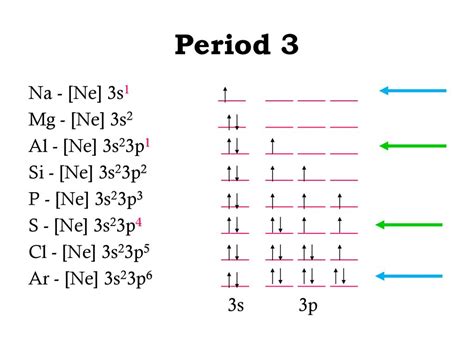
Электронная конфигурация представляет собой распределение электронов в энергетических уровнях атома. Она играет ключевую роль в определении химических свойств атома и его реакционной способности. Рассмотрим сравнение двух предложенных электронных конфигураций: 3s23p1 и 3s2 3s1 3s23p2.
Первая электронная конфигурация 3s23p1 означает, что в атоме наиболее активного металла имеется 3 электрона на энергетическом уровне 3s и 1 электрон на энергетическом уровне 3p.
Вторая электронная конфигурация 3s2 3s1 3s23p2 указывает на наличие 2 электронов на энергетическом уровне 3s, еще 1 электрона на энергетическом уровне 3s и 2 электронов на энергетическом уровне 3p.
Сравнивая эти две электронные конфигурации, можно заметить, что у них есть общий энергетический уровень 3s, на котором находятся электроны. Однако, в первой электронной конфигурации имеется только 1 электрон на уровне p, в то время как во второй конфигурации есть 2 электрона на уровне p.
Это означает, что вторая электронная конфигурация более стабильна, так как на уровне p находятся 2 электрона, что обеспечивает более полное заполнение этого уровня и большую силу притяжения ядра к электронам на этом уровне. В итоге, атом с такой электронной конфигурацией будет более активен и реакционноспособен.
Вопрос-ответ

Какая электронная конфигурация является электронной конфигурацией наиболее активного металла: 3s23p1 или 3s2 3s1 3s23p2?
Наиболее активным металлом является атом с электронной конфигурацией 3s23p1. Это означает, что в его внешней оболочке имеется один электрон, который может участвовать в химических реакциях.
Какие атомы будут образованы, если у атома наиболее активного металла есть электронная конфигурация 3s23p1?
Атомы с электронной конфигурацией 3s23p1 являются наиболее активными металлами и образуют положительные ионы со значением заряда +1. Например, атом натрия (Na) имеет такую электронную конфигурацию и образует ион Na+.
Какая электронная конфигурация более типична для наиболее активных металлов: 3s23p1 или 3s2 3s1 3s23p2?
Электронная конфигурация 3s23p1 является более типичной для наиболее активных металлов. Она указывает на наличие одного электрона в внешней оболочке, что предопределяет высокую активность металла в химических реакциях и его способность образовывать положительные ионы.
Почему атомы с электронной конфигурацией 3s23p1 являются наиболее активными металлами?
Атомы с электронной конфигурацией 3s23p1 являются наиболее активными металлами, потому что в их внешней энергетической оболочке имеется один электрон, который легко отдают при взаимодействии с другими атомами. Это позволяет им образовывать положительные ионы и активно участвовать в химических реакциях.
Какие элементы в периоде таблицы элементов имеют электронную конфигурацию 3s23p1?
Элементы периода таблицы элементов, у которых электронная конфигурация 3s23p1, включают в себя: калий (K), кальций (Ca), скандий (Sc), титан (Ti), ванадий (V), хром (Cr) и многие другие. Эти элементы обладают высокой активностью и образуют ионы со зарядом +1.
