Электронная конфигурация – это представление расположения электронов в атоме. Изучение электронной конфигурации позволяет понять, как происходят химические реакции, связанные с передачей и принятием электронов. Активность элементов зависит от их электронной конфигурации, поэтому особое внимание уделяется наиболее активному металлу.
Наиболее активным металлом считается флюор. Его электронная конфигурация обеспечивает высокую активность в химических реакциях. Флюор принадлежит к группе элементов, называемой щелочными металлами, и является самым легким и реакционноспособным в этой группе.
Электронная конфигурация флюора состоит из 9 электронов: 1s2 2s2 2p5. Это значит, что внешний энергетический уровень флюора имеет 7 электронов, что делает его легко реагирующим элементом. Флюор имеет большую склонность отдавать электроны, что делает его отличным веществом для производства взрывчатых веществ и ракетного топлива.
Активность флюора обусловлена его электронной конфигурацией и положением в таблице Менделеева. Наибольшая активность у металлов проявляется в различных химических реакциях, включая окисление, водородные реакции и образование солей. Флюор может реагировать с большинством элементов, за исключением инертных газов и некоторых редких металлов.
Итак, электронная конфигурация флюора – 1s2 2s2 2p5 – обеспечивает его высокую активность в химических реакциях. Исключительная реакционноспособность флюора делает его важным элементом во многих областях, включая производство взрывчатых веществ и ракетного топлива.
Что такое электронная конфигурация металла?

Электронная конфигурация металла описывает распределение электронов в атоме металла по энергетическим уровням и подуровням. Она играет важную роль в определении химических и физических свойств металла, а также его активности и реакционной способности.
Электронная конфигурация состоит из двух частей: первая часть указывает на энергетический уровень, а вторая часть указывает на подуровень, на котором находятся электроны. Символически электронная конфигурация записывается в виде набора чисел и букв, где число обозначает энергетический уровень, а буква обозначает подуровень.
Металлы, как правило, имеют относительно небольшую электронную конфигурацию в своей валентной оболочке, что делает их активными и склонными к реакциям. Валентная оболочка металла обычно заполняется электронами до половины, а затем остаются свободные электроны, которые легко могут участвовать в химических реакциях или образовывать ионную связь с другими атомами.
Электронная конфигурация металла определяет его химические и физические свойства, такие как температура плавления и кипения, электропроводность и металлический блеск. Кроме того, электронная конфигурация может изменяться в зависимости от окружающей среды и условий, что может вызывать изменение свойств металла.
Что такое электронная конфигурация?
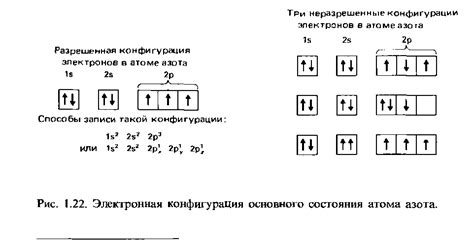
Электронная конфигурация - это упорядоченная последовательность электронов, занимающих энергетические уровни атома или молекулы. Она определяет распределение электронов по энергетическим оболочкам и подуровням.
В атоме присутствуют энергетические уровни, которые состоят из энергетических оболочек. Каждая оболочка имеет фиксированную энергию и может содержать определенное количество электронов.
Электроны в атоме заполняют энергетические уровни, начиная с наиболее близкого к ядру и постепенно переходя на более удаленные оболочки. Электроны на одной оболочке называются электронной подоболочкой.
Электронная конфигурация определяет структуру атома и его химические свойства. Наиболее активные металлы имеют электронную конфигурацию, в которой внешний энергетический уровень неполностью заполнен, что позволяет им взаимодействовать с другими атомами и образовывать химические соединения.
Что такое металл и его активность?

Металл - это химический элемент, обладающий определенными физическими и химическими свойствами. Металлы обладают высокой теплопроводностью и электропроводностью, имеют металлический блеск, обычно твердые при комнатной температуре и обладают пластичностью. Они существуют в различных формах, от крупных структурных элементов до микроскопических частиц.
Активность металла - это способность металла взаимодействовать с другими веществами. Она определяется способностью металла отдавать электроны при химических реакциях, что связано с его электрохимическим потенциалом. Чем выше электрохимический потенциал металла, тем более активным он считается.
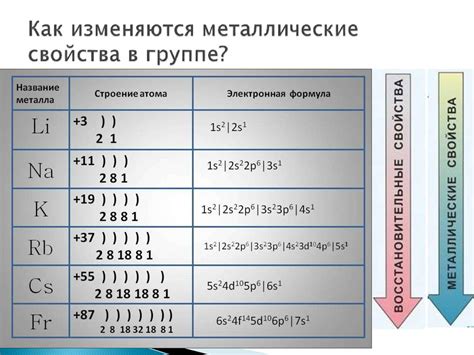
Активность металлов влияет на их реакционную способность. Наиболее активные металлы, такие как литий, натрий, калий, реагируют с водой или кислородом даже при низких температурах. Они способны сильно окисляться и ионизироваться при взаимодействии с другими веществами.
Активность металлов также связана с их электрохимическим потенциалом и способностью выступать в окислительно-восстановительных реакциях. Металлы с более высокими электрохимическими потенциалами, такие как калий и натрий, имеют большую активность и более легко вступают в химические реакции с другими веществами.
Изучение активности металлов имеет важное значение для различных областей, включая химию, электрохимию и материаловедение. Знание об активности металлов позволяет предсказывать и контролировать их реакционную способность, что находит применение в разработке новых материалов, создании батарей и других электрохимических устройств, а также в процессах обработки металлов и их сплавов.
Основные свойства наиболее активного металла
Наиболее активным металлом в периодической системе является флюор. Он обладает рядом уникальных свойств, которые делают его особо реактивным и полезным в различных процессах.
Первое отличительное свойство флюора - его высокая реактивность. Он сильно взаимодействует с большинством других элементов, образуя различные соединения. Это делает его одним из основных компонентов в производстве многих химических веществ и материалов.
Кроме того, флюор обладает высокой электроотрицательностью, что делает его отличным агентом для окисления и вытеснения других элементов из их соединений. Он способен реагировать с большинством металлов, образуя стабильные соли и оксиды.
Флюор также характеризуется низкой плотностью и низкой температурой плавления, что делает его легким и удобным материалом для различных промышленных процессов. Он применяется в производстве стали и алюминия, а также в производстве специальных сплавов и керамики.
Из-за своей активности и реакционности, флюор хранится в специальных условиях, чтобы избежать его нежелательного взаимодействия с влажностью или воздухом. Он также требует осторожного обращения и использования в лабораторных условиях, чтобы избежать возможных опасностей при его обработке.
Как определить электронную конфигурацию?
Электронная конфигурация является уникальным распределением электронов в атоме или ионе. Определение электронной конфигурации позволяет понять, какие энергетические уровни и подуровни заполнены электронами. Это важно для понимания химических свойств вещества.
Существует несколько способов определения электронной конфигурации. Один из них - использование периодической таблицы элементов. Каждый элемент имеет определенное количество электронов, которое может быть вычислено на основе его атомного номера. Например, атом водорода имеет одного электрона, а атом гелия - два. Зная атомный номер элемента, можно определить общее количество его электронов.
Далее, электронная конфигурация определяется по следующим правилам. Первыми заполняются энергетически более низкие уровни, а затем более высокие. Каждый энергетический уровень имеет свои подуровни, обозначаемые буквами s, p, d, f и т.д. Подуровни заполняются электронами последовательно, сначала одним электроном на каждый спин, а затем парами, используя правила заполнения.
Например, возьмем атом кислорода, у которого атомный номер 8. По таблице, мы знаем, что у него должно быть 8 электронов. Таким образом, электронная конфигурация кислорода будет 1s2 2s2 2p4. Это означает, что на первом уровне (n=1) находится 2 электрона в s-орбитали, на втором уровне (n=2) - 2 электрона в s-орбитали и 4 электрона в p-орбитали.
Важно отметить, что электронная конфигурация может меняться, например, в ионах или атомах, находящихся под воздействием других веществ. Также, существуют исключения и особенности в заполнении подуровней, которые могут быть учтены при определении электронной конфигурации.
Вопрос-ответ

Какие элементы обладают наиболее активной электронной конфигурацией?
Наиболее активными металлами являются щелочные и щелочноземельные металлы в периодической системе элементов.
Что означает наиболее активная электронная конфигурация металла?
Наиболее активное металлы имеют наружнюю электронную оболочку, состоящую из одного или двух электронов, что делает их очень реактивными и способными легко взаимодействовать с другими веществами.
