Металлы - важные элементы, которые играют ключевую роль в промышленности и повседневной жизни. Исследование и понимание электронной конфигурации металлов является важным аспектом их химических свойств и реактивности. Один из самых активных металлов в периодической системе элементов - это литий.
Литий - первый элемент в периодической системе и является элементом первой группы и первого периода. У него атомный номер 3 и химический символ Li. Литий имеет электронную конфигурацию 1s^2 2s^1, что означает, что у него есть два электрона на первом энергетическом уровне и один электрон на втором энергетическом уровне.
Электронная конфигурация лития делает его очень реактивным металлом. Он обладает низкой энергией ионизации, что означает, что его электроны легко могут быть удалены. В результате, литий проявляет высокую реактивность и может легко образовывать ионы Li+ путем потери своего одного электрона.
Когда литий реагирует с водой, происходит яркое воспламенение, так как образуется воспламеняемый газ - водород. Реакция лития с водой проходит по следующему уравнению:2Li + 2H2O -> 2LiOH + H2
Электронная конфигурация лития также объясняет его способность образовывать соединения с другими элементами. Литий образует соли с отрицательно заряженными атомами, такими как фтор, хлор, бром и йод. Эти соединения часто используются в батареях, стекле и фармацевтической промышленности.
Электронная конфигурация металлического элемента
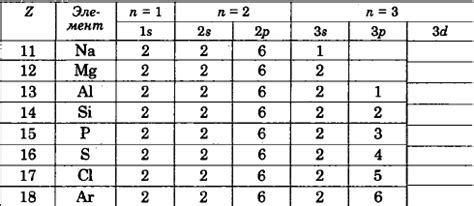
Электронная конфигурация металлического элемента – это способ представления расположения электронов в его атоме или ионе. Эта конфигурация определяет основные свойства элемента, включая его химическую активность.
Металлы – это класс химических элементов, обладающих определенными физическими и химическими свойствами. Они обычно имеют высокую электропроводность, гибкость, блеск, хорошую теплопроводность и высокую плотность. Металлические элементы находят широкое применение в различных областях, таких как промышленность, строительство, электроника и многие другие.
Электронная конфигурация металлического элемента представляет собой запись чисел и букв, которая показывает, сколько электронов находится в каждой энергетической оболочке. Энергетические оболочки представляют уровни энергии, на которых расположены электроны. Обычно конфигурация записывается по следующему принципу: номер оболочки, буква оболочки и количество электронов в данной оболочке.
Например, электронная конфигурация наиболее активного металла – лития – выглядит следующим образом: 1s^2 2s^1. Эта конфигурация показывает, что в атоме лития на первой оболочке (обозначается числом 1) находятся 2 электрона, а на второй оболочке (обозначается буквой s и числом 2) находится 1 электрон. Такая конфигурация делает литий наиболее активным металлом, способным образовывать ион с положительным зарядом – Li+.
Свойства самого активного металла
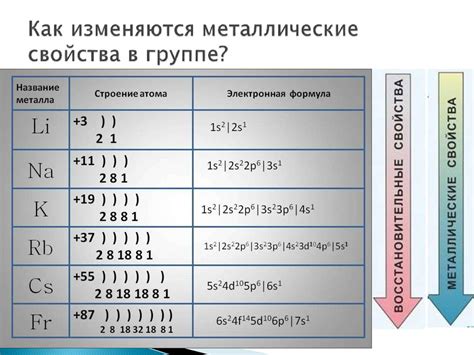
Самым активным металлом в периодической таблице элементов является фтор (F). Его атомы имеют 9 электронов и обладают неустойчивым внешним электронным слоем с одним свободным местом. В результате этого фтор стремится активно реагировать с другими веществами в целях заполнения внешнего электронного слоя и достижения стабильности.
Фтор обладает рядом уникальных свойств, которые делают его наиболее активным металлом:
- Высокая электроотрицательность: Фтор является самым электроотрицательным элементом в периодической таблице. Это означает, что он проявляет сильную способность притягивать электроны к себе. Благодаря этому свойству, фтор является мощным окислителем и может образовывать соединения с различными элементами.
- Реактивность: Благодаря своей нестабильной электронной конфигурации, фтор проявляет высокую реактивность. Он способен реагировать с многими веществами, включая другие металлы, неметаллы и органические соединения. Фтор может образовывать ковалентные, ионные и пи-соединения, в зависимости от свойств реагирующих веществ.
- Сильная окислительная активность: Фтор имеет способность окислять другие вещества, передавая им электроны. Он может образовывать стабильные соединения с элементами, обладающими более низкой электроотрицательностью. Это свойство делает фтор полезным в различных процессах окисления и флуорирования, в том числе в химической промышленности и производстве лекарственных веществ.
Все эти свойства делают фтор наиболее активным металлом. Однако его высокая реактивность также делает его очень опасным и требует особой осторожности при обращении с ним.
Особенности электронной оболочки

Электронная оболочка атома металла является одной из ключевых характеристик, определяющих его активность. Металлы характеризуются наличием нескольких электронных уровней и различным расположением электронов на этих уровнях.
Наиболее активный металл отличается особенностями своей электронной оболочки. Оболочка состоит из электронных уровней, на которых располагаются электроны. На самом активном металле эти электроны находятся на неполностью заполненных энергетических уровнях, что делает его нестабильным и склонным к реакциям с другими веществами и элементами.
Наиболее активный металл в периодической системе элементов - это франций (Fr). У этого металла атом содержит 87 электронов, расположенных на 7 электронных уровнях. Последний, седьмой уровень, содержит всего один электрон, что делает этот элемент наиболее активным из всех металлов.
Активность металлов определяется их способностью отдавать электроны. Все металлы стремятся достичь наиболее устойчивого электронного состояния, заполнив полностью энергетические уровни. Поэтому наиболее активные металлы находятся в левой части периодической системы элементов, ближе к семейству щелочных металлов.
Строение атома металла
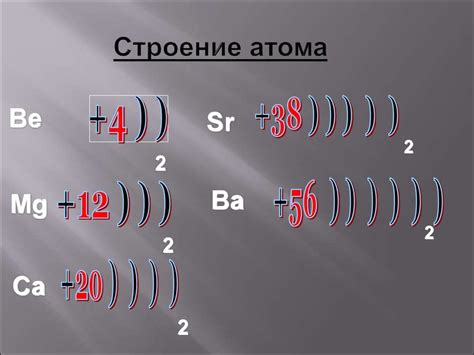
Атом металла представляет собой элементарную частицу, обладающую электрическим зарядом и состоящую из ядра и электронной оболочки. В ядре атома находятся нейтроны и протоны, которые обладают положительным зарядом. Нейтроны не имеют заряда, а протоны имеют положительный заряд. Электронная оболочка состоит из электронов, которые обладают отрицательным зарядом.
В электронной оболочке атома металла находятся энергетические уровни, на которых располагаются электроны. Каждый энергетический уровень может вместить определенное количество электронов. На первом энергетическом уровне может находиться не более 2 электронов, на втором - не более 8 электронов, на третьем - не более 18 электронов и так далее.
Распределение электронов по энергетическим уровням определяет электронную конфигурацию атома металла. Электронная конфигурация определяет свойства металла, так как взаимодействие электронов между собой и с ядром атома влияет на его химическую активность и способность образовывать связи с другими атомами.
Наиболее активный металл - это металл, у которого нарушена электронная конфигурация, что приводит к высокой реактивности. У таких металлов в электронной оболочке на верхнем энергетическом уровне находится один электрон или несколько электронов, что делает их более склонными к электронному взаимодействию и образованию ионов. Это свойство активных металлов определяет их способность к химическим реакциям и образованию соединений с другими элементами.
Принципы заполнения электронных оболочек металлов

Электроны в атоме металла распределены по энергетическим уровням и облакам, называемым электронными оболочками. Принципы заполнения этих оболочек определяют структуру и свойства металлов.
Металлы характеризуются своей высокой электропроводностью, гибкостью и хорошей теплопроводностью. Эти свойства связаны с особым распределением электронов в их электронных оболочках.
Заполнение электронных оболочек металлов осуществляется в соответствии с двумя принципами: принципом минимальной энергии и принципом Паули. По принципу минимальной энергии электроны заполняют свободные уровни энергии на наиболее низком уровне. Принцип Паули гласит, что в каждом электронном орбитале может находиться не более двух электронов с противоположным спином.
Металлы, как правило, имеют небольшое количество электронов в внешней электронной оболочке, называемой валентной оболочкой. Валентные электроны определяют химическую активность металлов и их способность образовывать химические связи. Чаще всего металлы стремятся заполнить свою валентную оболочку, чтобы достичь наиболее стабильной конфигурации.
Наиболее активные металлы, такие как литий и натрий, имеют один электрон в валентной оболочке. Они демонстрируют высокую реактивность и готовность отдать этот электрон для образования ионов с положительным зарядом. Наиболее активные металлы расположены в левой части периодической системы химических элементов.
Роль электронной конфигурации в химических реакциях

Электронная конфигурация - это упорядоченное распределение электронов в атоме или молекуле. Эта конфигурация определяет химические свойства вещества и его реакционную способность. В химических реакциях электроны играют ключевую роль, поскольку взаимодействие электронных оболочек атомов или молекул определяет характер и результаты реакций.
Электронная конфигурация определяет степень устойчивости атомов или молекул и их потенциал для взаимодействия с другими веществами. Например, если атом имеет неполный электронный слой, он будет стремиться получить или отдать электроны, чтобы достичь более устойчивой конфигурации. Поэтому атомы с неполными внешними электронными оболочками часто проявляют химическую активность и могут легко участвовать в химических реакциях.
Результирующая химическая реакция зависит от ионосостояния атомов и их электронной конфигурации. К примеру, электроотрицательность элемента может быть связана с его электронной конфигурацией. Атомы с большим количеством электронов во внешней электронной оболочке (например, атомы кислорода) имеют большую электроотрицательность и могут активно принимать электроны, образуя отрицательные ионы. С другой стороны, атомы с неполными внешними электронными оболочками, как активные металлы, имеют меньшую электроотрицательность и могут легко отдавать электроны, образуя положительные ионы.
Электронная конфигурация также влияет на способность соединений к обмену электронами в химических реакциях. Например, в ковалентных соединениях электроны могут быть обменены между атомами для образования новых связей. Через этот обмен электронов происходят такие процессы, как образование и разрыв связей, образование ионосферных соединений и превращение одних веществ в другие.
В целом, электронная конфигурация является важным фактором, определяющим реакционную способность вещества и его поведение в химических реакциях. Понимание электронной конфигурации позволяет предсказать, какие типы соединений могут быть образованы, и как эти соединения будут разлагаться или взаимодействовать с другими веществами.
Практическое применение металла с данной электронной конфигурацией

Металл с электронной конфигурацией, характеризующейся наивысшим уровнем энергии s-орбиталей, обладает рядом уникальных свойств, которые находят широкое практическое применение в различных отраслях науки и технологий.
Электронная конфигурация наиболее активного металла обеспечивает ему высокую реакционную способность, что делает его идеальным материалом для производства химических соединений. Металл с такой электронной конфигурацией может служить катализатором в химических реакциях, ускоряя их протекание и повышая эффективность процессов синтеза.
Из-за высокой реакционной способности металла с данной электронной конфигурацией он активно применяется в производстве аккумуляторов и батарей. Такие аккумуляторы обладают высокой энергоемкостью и обеспечивают длительное время автономной работы различных устройств, таких как мобильные телефоны, ноутбуки, электромобили.
Другим практическим применением металла с данной электронной конфигурацией является его использование в производстве катализаторов для промышленных процессов. Катализаторы на основе этого металла обладают высокой активностью и стабильностью, что позволяет ускорить реакции и повысить эффективность процессов, таких как производство пластмасс, нефтехимические процессы, синтез фармацевтических препаратов и другие.
Еще одним важным направлением применения металла с такой электронной конфигурацией является его использование в электронной промышленности. Этот металл обладает высокой электропроводностью, что позволяет его применять в производстве электронных компонентов, проводников и различных устройств, таких как микрочипы, транзисторы, солнечные батареи и др.
Вопрос-ответ

Что такое электронная конфигурация металла?
Электронная конфигурация металла — это распределение электронов по энергетическим уровням и подуровням в атоме металла. Она определяет, сколько электронов находится на каждом уровне и подуровне, что влияет на химические свойства металла.
Как определить наиболее активный металл по его электронной конфигурации?
Наиболее активный металл имеет электронную конфигурацию, в которой его внешний энергетический уровень имеет только один или два электрона. Такая конфигурация говорит о том, что металл легко может отдавать эти электроны и образовывать положительные ионы. Например, наиболее активным металлом является литий, у которого электронная конфигурация 1s2 2s1.
Какие металлы считаются наиболее активными?
В качестве наиболее активных металлов обычно выделяют металлы первой группы периодической таблицы, такие как литий (Li), натрий (Na), калий (K) и др. У этих металлов на внешнем энергетическом уровне всего один электрон, поэтому они легко отдают его и образуют положительные ионы. Эти металлы быстро реагируют с водой и кислородом, образуя гидроксиды и оксиды соответственно.
