Металлы являются одним из основных классов химических элементов и имеют широкий спектр применений в различных отраслях промышленности и науки. Обычно атомы металлов имеют электрическую зарядку равную нулю, однако они могут приобретать положительную или отрицательную зарядку при взаимодействии с веществом или внешними электрическими полями.
Одним из основных свойств заряженных атомов металлов является их способность привлекать или отталкивать другие заряженные частицы. Заряженные атомы металлов создают электростатическое поле вокруг себя, которое влияет на поведение других атомов и молекул. Это поле приводит к возникновению электростатических сил притяжения или отталкивания, которые определяют различные химические и физические свойства металлов.
Важным параметром заряженного атома металла является его электростатический потенциал, который определяет энергию, необходимую для приведения другой заряженной частицы к данному атому. Чем выше электростатический потенциал заряженного атома металла, тем сильнее он может притягивать или отталкивать другие атомы или молекулы. Это свойство имеет прямое отношение к химической реактивности металлов, и может быть полезным при определении их способности взаимодействовать с другими веществами.
Структура атома металла и его составляющие элементы
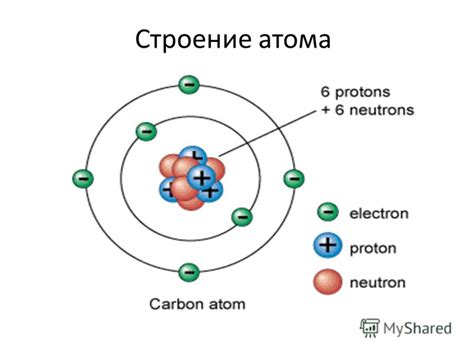
Атом металла представляет собой небольшую частицу, состоящую из положительно заряженного ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, которые имеют положительный и нейтральный заряды соответственно. Протоны определяют химические свойства элемента, а нейтроны обеспечивают его стабильность.
Электронная оболочка атома металла окружает его ядро и состоит из электронов, которые имеют отрицательный заряд. Внешние электроны, находящиеся на самом удаленном уровне, называются валентными электронами и определяют химические свойства металла. Именно взаимодействие валентных электронов между собой и с другими атомами определяет основные свойства металлов, такие как проводимость электричества и тепла.
Количество электронов в атоме металла определяется атомной структурой элемента и его порядковым номером в таблице химических элементов. Например, у водорода всего один электрон, а у свинца их 82. Внутри атома металла электроны заполняют энергетические уровни по аналогии с моделью электрона в атоме водорода. Каждый уровень может вмещать определенное число электронов, их количество увеличивается по мере удаления от ядра.
Таким образом, структура атома металла и его составляющие элементы, такие как ядро, электронная оболочка и валентные электроны, играют ключевую роль в определении свойств и поведения металлов.
Заряд атома металла и его влияние на свойства
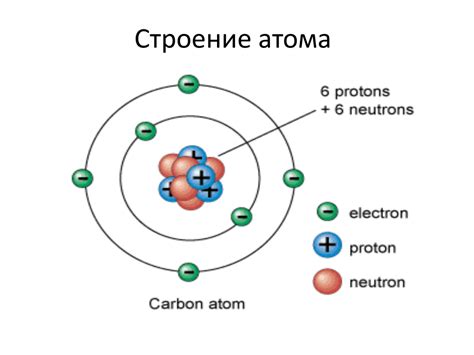
Атомы металлов обладают особым свойством — они имеют положительный заряд ядра. Заряд атома металла определяется количеством протонов в ядре, а также количеством электронов, окружающих ядро. Положительный заряд ядра обусловлен наличием протонов, которые имеют положительный электрический заряд.
Заряд атома металла имеет существенное влияние на его свойства. Внутри металла содержатся свободные электроны, которые способны передвигаться под воздействием внешнего электрического поля. Благодаря положительному заряду ядра и наличию свободных электронов, металлы обладают высокой проводимостью электрического тока.
Заряд атома металла также определяет его атомный радиус. Атомный радиус металла обычно меньше, чем у неметаллов, так как в металлах сильно затяжной межатомный скелет. Это делает металлы плотными и твердыми материалами.
Кроме того, заряд атома металла влияет на его химическую активность. Металлы обладают способностью отдавать электроны при взаимодействии с другими химическими элементами. Благодаря этому, металлы проявляют активную химическую реакцию и образуют различные соединения.
Электронная оболочка атома металла и ее роль в химических реакциях
Электронная оболочка атома металла является важным аспектом его химических свойств и реакций. В ней расположены электроны - элементарные частицы, которые образуют электронную оболочку и определяют поведение атома в химических реакциях.
Число электронов в оболочке и их распределение по энергетическим уровням имеют особое значение. Электронная конфигурация атома металла определяет его химическую активность и способность образовывать связи с другими атомами.
Металлы, обладающие неполной внешней оболочкой электронов, стремятся осуществлять химические реакции с другими веществами, чтобы достичь стабильной конфигурации с полной оболочкой. Это может происходить через передачу, прием или совместное использование электронов с другими атомами.
В химических реакциях атомы металла могут образовывать ионные соединения, координационные соединения или сплавы с другими элементами. Ионы металла могут образовывать положительные заряды, как в положительных ионах в растворах, так и в кристаллической решетке.
Способность атомов металла образовывать связи с другими атомами и ионами определяет их химическую реакционную способность и может быть использована в различных процессах, таких как катализ или электрохимия.
Все эти свойства электронной оболочки атома металла являются важными факторами при изучении и понимании его химических реакций и применении в различных сферах, включая материаловедение и производство различных изделий.
Физические свойства заряженного атома металла и их практическое применение

Заряженный атом металла обладает рядом уникальных физических свойств, которые находят широкое практическое применение в различных областях науки и техники.
Одним из главных свойств заряженного атома металла является его электропроводность. Металлы отличаются от других материалов тем, что их атомы могут легко перемещаться под воздействием электрического поля. Благодаря этому, металлы широко используются в электротехнике и электронике. Они служат материалом для изготовления проводов, контактов, транзисторов и других электронных компонентов.
Еще одним важным свойством заряженного атома металла является его теплопроводность. Металлы обладают способностью быстро и равномерно передавать тепло. Благодаря этому свойству, металлы применяются в производстве теплообменных устройств, таких как радиаторы и теплоотводы. Они также используются в производстве кастрюль и сковородок, где необходимо равномерно распределять тепло по всей поверхности.
Заряженный атом металла обладает еще одним полезным свойством - магнетизмом. Некоторые металлы, такие как железо, никель и кобальт, обладают способностью притягивать или отталкивать магнитные материалы. Это свойство металлов используется в производстве постоянных магнитов и электромагнитов, которые широко применяются в различных устройствах, включая электродвигатели, генераторы и магнитные системы для хранения данных.
Таким образом, физические свойства заряженного атома металла имеют важное практическое значение и находят широкое применение в различных сферах науки и техники. Они позволяют использовать металлы для создания электронных компонентов, теплообменных устройств, а также магнитных систем.
Химические свойства заряженного атома металла и их значение в синтезе соединений

Химические свойства заряженного атома металла играют важную роль в синтезе соединений. Заряд атома металла, наблюдающийся при окислении или восстановлении, определяет его активность и способность образовывать различные соединения.
Одним из основных химических свойств заряженного атома металла является его реакционная способность. Заряженный атом металла может вступать в реакции с другими атомами или группами атомов, образуя разнообразные химические соединения. Это позволяет использовать металлы в процессе синтеза различных веществ, включая органические и неорганические соединения.
Значение химических свойств заряженного атома металла в синтезе соединений также связано с его электрохимическими свойствами. Заряд атома металла определяет его положительный потенциал окисления, что позволяет использовать металлы в электрохимических процессах, таких как электролиз и гальваническая коррозия. Кроме того, заряженный атом металла может служить катализатором реакций, повышая их скорость и эффективность.
Химические свойства заряженного атома металла также влияют на его способность образовывать комплексные соединения. Заряженный атом металла может взаимодействовать с лигандами, образуя стабильные комплексы. Это имеет особое значение в координационной химии, где комплексы металла играют важную роль в катализе реакций, синтезе новых веществ и химических превращениях.
Интересные физические и химические свойства заряженного атома металла и его соединений позволяют использовать их в различных областях химии, таких как катализ, электрохимия, органический синтез и наноматериаловедение. Изучение и понимание этих свойств открывает новые возможности для разработки новых материалов и технологий, а также помогает улучшить существующие процессы и производственные методы.
Изменение свойств заряженного атома металла под воздействием внешних факторов
Заряженный атом металла характеризуется определенными свойствами, которые могут изменяться под воздействием различных внешних факторов. Эти факторы могут включать изменение температуры, давления, влажности окружающей среды, а также воздействие электрического поля или магнитного поля.
Один из основных эффектов, наблюдаемых при изменении внешних условий, - это изменение энергетических уровней электронов в атоме металла. В результате изменения энергетических уровней могут меняться такие свойства заряженного атома металла, как его проводимость, реактивность и магнитные свойства.
Изменение температуры, например, может привести к возникновению изменений в энергии связи электронов с атомами металла. При повышении температуры возрастает энергия ионизации, что повышает степень ионизации ионов металла и, как следствие, его проводимость. Понижение температуры, в свою очередь, может снижать проводимость за счет уменьшения энергии свободных электронов.
Другой фактор, который оказывает влияние на свойства заряженного атома металла, – это магнитное поле. Под воздействием магнитного поля могут возникать изменения в ориентации спинов электронов, что может приводить к изменению магнитных свойств атомов. Например, магнитное поле может помочь сориентировать спины электронов и в результате усилить магнитные свойства металла или, наоборот, сориентировать спины в противоположную сторону и уменьшить магнитные свойства.
Таким образом, изменение свойств заряженного атома металла под воздействием внешних факторов является важным аспектом изучения его поведения и может быть использовано для создания новых материалов с желаемыми свойствами.
Вопрос-ответ

Каковы основные свойства заряженного атома металла?
Основные свойства заряженного атома металла включают высокую электропроводность, металлический блеск, формирование положительной иона зарядки, и способность образования катионов.
Какая роль заряженных атомов металла в химических реакциях?
Заряженные атомы металла играют важную роль в химических реакциях, так как они могут передавать свои электроны другим атомам или ионам, что влияет на скорость и характер реакции. Они также способны образовывать соединения с другими элементами, образуя соли и металлокомплексы.
