Атомы металла отличаются от атомов неметаллов своей способностью без проблем отдавать свои электроны. Это свойство называется металлическими свойствами и обусловлено особенностями строения атомов металла.
Строение атома металла включает ядро, состоящее из протонов и нейтронов, а также электронную оболочку, на которой находятся электроны. В отличие от атомов неметаллов, у атомов металла электронная оболочка содержит много свободных электронов, которые слабо связаны с ядром.
Именно благодаря этому, атом металла может легко отдавать свои электроны, что является основой для многих металлических свойств. Например, металлы отличаются хорошей электропроводностью и теплопроводностью, так как свободные электроны могут свободно перемещаться по материалу и переносить заряд или тепло. Кроме того, металлы обладают хорошей пластичностью и деформируются под действием внешних сил без разрушения, потому что свободные электроны позволяют атомам металла легко передвигаться друг относительно друга.
Металлические свойства атомов металла определяют их поведение в различных условиях и играют ключевую роль в области физики, химии и материаловедения.
Электроны в металлических атомах
Металлы представляют собой материалы, которые обладают высокой электропроводностью. Эта особенность металлов связана с особенностями электронной структуры атомов, из которых они состоят.
В металлическом атоме внешний энергетический уровень, также называемый валентным уровнем, не заполнен полностью. Это означает, что на валентном уровне находится меньше электронов, чем может вместить. Благодаря этому, атомы металлов могут легко отдавать свои электроны.
Электроны на валентном уровне обладают меньшей привязанностью к атому, поэтому они могут легко перемещаться между атомами металла. Такой свободный электронный газ ответственен за электропроводность металлов.
Процесс, при котором атомы металла отдают свои электроны, называется ионизацией. При ионизации атомы становятся положительно заряженными и превращаются в ионы. Свободные электроны, в свою очередь, движутся под действием электрического поля и создают электрический ток.
Из-за особенностей электронной структуры, атомы металлов обладают высокой электрической и теплопроводностью. Это делает металлы ценными материалами для использования в различных областях, включая электротехнику, строительство и машиностроение.
Процесс отдачи электронов

Атом металла имеет особую структуру, которая позволяет ему легко отдавать свои электроны. Этот процесс называется ионизацией. При воздействии на металл энергии в форме тепла или света, атом начинает колебаться, а его электроны включаются в движение.
В условиях нагревания или освещения энергия, передаваемая атомам, достигает определенного порогового значения. При превышении порога атомы в металле обретают достаточную энергию для преодоления силы притяжения ядра. Электроны, находящиеся на внешних уровнях энергии, могут оторваться от атома и стать свободными электронами.
Особенность атомов металла заключается в том, что они имеют несколько электронов на своих внешних энергетических уровнях. Поэтому, когда один электрон отрывается от атома, происходит эффект домино - другие электроны начинают "смещаться" на свободное место. Это обеспечивает непрерывность процесса отдачи электронов.
Под влиянием внешней силы или при воздействии электрического поля, свободные электроны в металле начинают двигаться в определенном направлении. Процесс отдачи электронов подобно течению электрического тока. Благодаря этому свойству металлы широко применяются в электротехнике.
Особенности металлической связи
Металлическая связь – это особый тип химической связи, характерный для металлов. Одной из особенностей этой связи является то, что атом металла без проблем отдает свои электроны, образуя положительно заряженное ионное ядро и свободные электроны. Таким образом, в металлах электроны образуют "облако" или "море" свободных электронов, которые связываются с ионами металла.
Металлическая связь обеспечивает ряд уникальных свойств металлов. Во-первых, она придает металлам высокую электропроводность и теплопроводность, так как свободные электроны могут свободно передвигаться и переносить электрический и тепловой заряд. Во-вторых, металлическая связь обуславливает их способность к пластической деформации – металлы могут быть легко обработаны и вытянуты в проволоку.
Кроме того, металлы обладают блестящим металлическим блеском. Это связано с тем, что свободные электроны способны поглощать и перераспределять световые волны, что создает эффект отражения и отображения окружающей среды. Однако, металлическая связь также делает металлы способными к хорошей термообработке и сварке, что позволяет создавать разнообразные металлические конструкции и изделия.
Энергия электронов в атоме

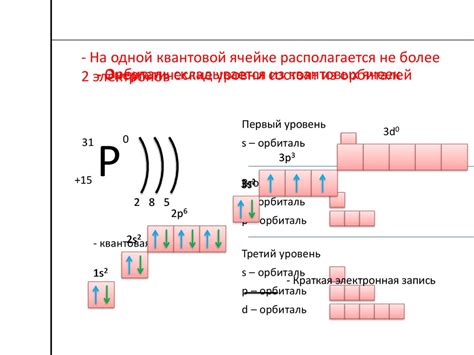
Электроны, находящиеся в атоме, обладают определенной энергией, которую можно представить в виде энергетических уровней. Каждый энергетический уровень соответствует определенной энергии электронов и характеризуется своими квантовыми числами.
Как же электроны получают энергию? В атоме металла электроны могут получать энергию, например, при воздействии на них электромагнитного излучения или при столкновении с другими частицами. При этом электроны переходят на более высокий энергетический уровень.
С другой стороны, электроны также могут выпускать энергию, возвращаясь на более низкий энергетический уровень. Этот процесс называется излучательной рекомбинацией электронов и сопровождается испусканием фотонов. Именно этот процесс лежит в основе работы светящихся источников, таких как газоразрядные лампы или светодиоды.
Каждый энергетический уровень в атоме имеет определенное значение энергии, которое зависит от конкретных условий и параметров атома. Энергия электронов в атоме может быть измерена и выражена в электрон-вольтах (эВ) или в единицах энергии, таких как жоули (Дж).
Таким образом, энергия электронов в атоме металла играет важную роль во многих процессах, связанных с предоставлением электронов для различных химических реакций и физических явлений. Понимание и контроль этой энергии позволяют создавать новые материалы и устройства с уникальными свойствами и функциональностью.
Роль валентных электронов
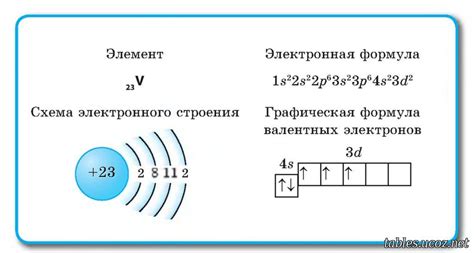
Валентные электроны – это электроны, находящиеся на самом высоком энергетическом уровне в атоме металла. Они играют ключевую роль в химических реакциях и свойствах металлов.
Валентные электроны отвечают за возможность металлов отдавать электроны другим атомам или соединениям. Благодаря этому свойству, металлы являются хорошими проводниками электричества и тепла. Валентные электроны обладают меньшей плотностью, чем внутренние электроны, что позволяет им свободно перемещаться по металлической структуре.
Количество валентных электронов в атоме металла определяется его положением в периодической таблице. Например, у атома металла из первой группы – это 1 валентный электрон, у атома из второй группы – 2 валентных электрона, и так далее. Для определения количества валентных электронов используются валентные электронные конфигурации, которые показывают расположение электронов на энергетических уровнях.
Валентные электроны определяют химические свойства металла: его способность к соединению с другими веществами и проявление металлического блеска. Часто валентные электроны образуют ковалентные связи с электронами атомов неметаллов, что приводит к образованию металлических соединений. Именно благодаря валентным электронам металлы проявляют свои уникальные свойства и применения в различных областях, включая электротехнику, машиностроение и строительство.
Механизм отдачи электронов при контакте

Взаимодействие атомов металла с другими веществами может привести к явлению отдачи электронов, что является одной из основных характеристик металлов. Отдача электронов происходит при контакте атомов металла с молекулами или атомами других веществ.
Механизм отдачи электронов заключается в том, что атом металла может перейти в более высокое энергетическое состояние и отдать свой электрон наружу своей валентной оболочки. Это происходит из-за высокой подвижности электронов в металлах, которая обусловлена их слабым аттракционным взаимодействием с ядрами атомов металла.
Отдача электронов при контакте может иметь различные последствия. Например, при контакте с веществами, способными принять электроны, металл может образовать ионы, приобретая положительный заряд. Также электроны, отданные атомами металла, могут участвовать в химических реакциях, образовывая новые соединения. Для некоторых металлов отдача электронов может играть решающую роль в их взаимодействии с внешней средой.
Отдача электронов при контакте является важным физико-химическим явлением, которое находит применение в различных областях науки и техники. Например, в электронике отдача электронов является основой работы полупроводников. В каталитических процессах отдача электронов может способствовать активации реакций и повышению их эффективности.
Формирование заряда металлов

Металлы являются источниками электронов, так как у атомов металла лишние электроны в валентной оболочке. Это свойство позволяет металлам легко отдавать электроны и образовывать положительный заряд.
Процесс формирования заряда в металлах называется ионизацией. При этом атомы металла теряют один или несколько электронов и превращаются в положительно заряженные ионы. Это происходит под воздействием внешнего фактора, например, при взаимодействии с кислородом или другим веществом.
Формирование заряда металлов обусловлено так называемым "морем свободных электронов". В кристаллической решетке металла электроны свободно движутся между положительно заряженными ионами металла. Благодаря этому, металлы обладают высокой проводимостью электричества и тепла.
Важно отметить, что заряд металлов не ограничивается одной степенью ионизации. Металлы могут образовывать ионы с различными степенями заряда, в зависимости от условий окружающей среды. Например, в кислородосодержащей среде металл образует положительные ионы с двумя зарядами, а в более кислотной среде может образовываться ион трехкратно заряженного металла.
Электронные облака и проводимость
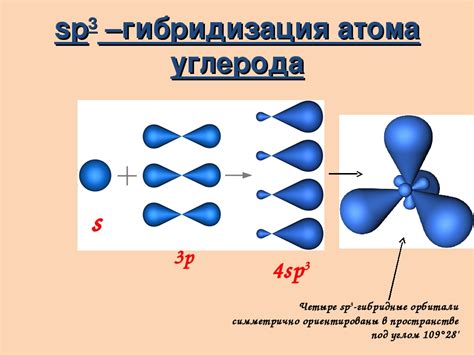
Атом металла состоит из ядра, в котором находятся протоны и нейтроны, и облака электронов, окружающих ядро. Именно электронные облака обладают свойством проводимости, благодаря которому металлы являются хорошими проводниками электричества.
Электроны, находящиеся в электронных облаках, могут свободно перемещаться по металлической структуре. Это связано с тем, что металлы имеют особую структуру, в которой электроны образуют так называемую "электронную газ", заполняющую весь объем металла.
При наличии внешнего электрического поля электроны начинают двигаться в определенном направлении по металлу. При этом электроны сталкиваются между собой и с атомами металла, но преобладает их свободное движение. В результате этого процесса возникает электрический ток.
Чем плотнее электронное облако в металле, тем лучше он проводит электрический ток. Количество свободных электронов зависит от многих факторов, таких как температура, тип металла и его структура.
Электронные облака в металлах также обладают другими интересными свойствами. Например, они способны отражать свет, создавая блеск металлической поверхности. Кроме того, электроны могут поглощать энергию и переходить на более высокие энергетические уровни, что приводит к возникновению электронных возбуждений и спектральным линиям.
Вопрос-ответ

Почему атом металла может без проблем отдавать свои электроны?
Атом металла может без проблем отдавать свои электроны из-за особенностей его электронной структуры. В металлах, электроны находятся в так называемой "области проводимости", где они свободны двигаться. Более того, металлы имеют низкую энергию ионизации, что означает, что для вырывания электронов из атома требуется минимальное количество энергии. Именно поэтому металлы являются хорошими проводниками электричества.
Какие металлы наиболее легко отдают свои электроны?
Наиболее легко отдают свои электроны щелочные металлы, такие как литий, натрий, калий и др. У этих металлов наименьшая энергия ионизации и высокая активность, что делает их хорошими проводниками электричества. Кроме того, ртуть и алюминий также обладают низкой энергией ионизации и способностью легко отдавать свои электроны.
Какие факторы влияют на способность металла отдавать свои электроны?
На способность металла отдавать свои электроны влияют ряд факторов. Один из основных факторов - энергия ионизации, которая определяет количество энергии, необходимой для вырывания электрона из атома. Чем ниже энергия ионизации, тем легче металл отдаст свои электроны. Кроме того, активность металла, возможность образования ионов и степень валентности также играют роль в способности металла отдавать свои электроны.
