Алюминий – один из наиболее распространенных и используемых металлов в мире. Он обладает рядом уникальных свойств, которые делают его неотъемлемой частью нашей повседневной жизни. Одним из таких свойств является особое расположение электронов в атоме алюминия.
Атом алюминия имеет 13 электронов, размещенных на четырех энергетических уровнях. На внешнем уровне, валентной оболочке, находятся всего лишь 3 электрона. Это делает атом алюминия очень реакционноспособным и способным образовывать химические связи с другими атомами.
Почему именно 3 электрона на внешнем уровне? Ответ на этот вопрос связан с строением энергетических уровней атома алюминия и его электронной конфигурацией. Алюминий находится в 13-й группе периодической системы, что означает, что у него 13 электронов и 13 протонов. Согласно правилу набора квантовых чисел, на внешнем уровне может находиться не более 8 электронов, но атом алюминия может вместить только 3 электрона на своем внешнем уровне.
Таким образом, атом алюминия обладает 3 свободными электронами на внешнем уровне, что делает его активным источником в химических реакциях.
Это свойство делает алюминий прекрасным материалом для создания различных сплавов, защитных покрытий и современных технологий. Алюминиевые сплавы применяются в авиации, строительстве, производстве упаковки и многих других областях, благодаря их прочности, легкости и устойчивости к коррозии.
Таким образом, внешний уровень алюминия с 3 электронами играет важную роль в его химической активности и используется в различных областях нашей жизни.
Алюминий: внешний уровень электронов
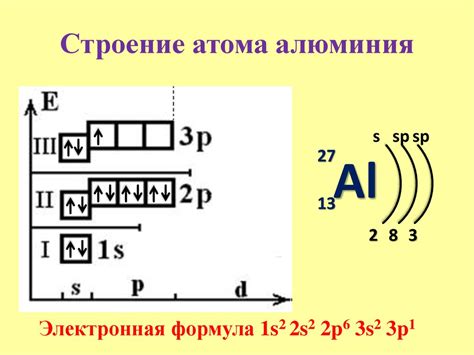
Алюминий (Al) - химический элемент с атомным номером 13 и атомной массой около 27 г/моль. Этот металл обладает светло-серым цветом и является одним из самых распространенных элементов на Земле. Его атомная структура имеет сложное расположение электронов в оболочках, но внешний уровень алюминия всегда содержит 3 электрона.
Внешняя оболочка алюминия, которая обычно называется 'p-оболочкой', содержит 3 электрона. Эти электроны находятся в трех различных p-орбиталях, каждая из которых может вместить до 2 электронов. Таким образом, атом алюминия заполняет только одну из этих трех p-орбиталей, оставляя две p-орбитали свободными и готовыми к химическим связям.
Такая структура внешней оболочки обуславливает основные свойства алюминия. Например, алюминий может образовывать трехзарядные катионы, потому что он может отдать все 3 электрона с внешней оболочки. Это также объясняет его высокую реакционную способность и способность образовывать соединения с другими элементами.
Вывод: атом алюминия имеет 3 электрона во внешней оболочке, что придает ему специфические химические свойства и способность образовывать соединения с другими элементами.
Строение атома алюминия
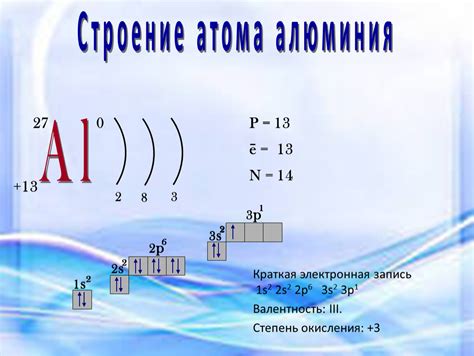
Алюминий - это химический элемент с атомным номером 13 и обозначением Al в таблице Mendeleev. Содержит 13 протонов в ядре и соответственно 13 электронов в оболочках. Атом алюминия имеет достаточно сложное строение и может быть описан с использованием различных моделей.
Внешний уровень алюминия представлен 3 электронами, которые находятся на третьей энергетической оболочке. Эти электроны образуют уровень заполнения собственного слоя. Благодаря этому, атом алюминия обладает высокой химической активностью и способностью образовывать соединения.
Атом алюминия может присоединять или отдавать электроны, чтобы достичь стабильного электронного состояния. Он имеет две валентные оболочки, первая из которых заполнена двумя электронами, а вторая - восемью. В результате атому алюминия необходимо получить или отдать 3 электрона, чтобы достичь стабильной конфигурации внешней оболочки, а именно 8 электронов. Таким образом, атом алюминия может образовывать ион с положительным зарядом на 3 единицы.
Такая способность алюминия образовывать ион с положительным зарядом делает его ценным металлом в различных областях промышленности. Алюминий широко используется в производстве авиационных и автомобильных деталей, строительных конструкций, пищевой упаковки и многих других отраслях.
Электронное правило
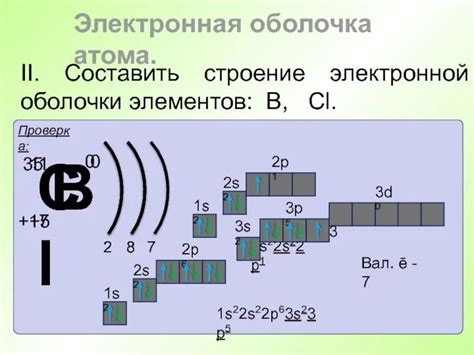
Электронное правило - это фундаментальный принцип, который объясняет почему атомы элементов имеют определенное количество электронов в их внешней оболочке. Согласно этому правилу, атом стремится достичь электронной конфигурации, аналогичной конфигурации инертного газа. Это означает, что атом стремится заполнить свою внешнюю оболочку электронами до уровня инертного газа, чтобы достичь стабильности.
Для аллюминия, который имеет атомный номер 13, электронное правило объясняет, почему у него 3 электрона на его внешнем уровне. В аллюминии на самом верхнем энергетическом уровне находятся 3 электрона. Это связано с тем, что аллюминий стремится достичь конфигурации инертного газа, а именно конфигурации гелия. Гелий имеет два электрона в своей внешней оболочке, поэтому атом аллюминия с 3 электронами также является достаточно стабильным.
Электронное правило является ключевым в объяснении химических свойств элементов и их способности образовывать соединения. Имея внешний уровень с 3 электронами, атом аллюминия может образовывать связи с другими элементами, чтобы достичь стабильности. Это объясняет его способность образовывать различные соединения и проявлять металлические свойства.
Химические свойства алюминия

Алюминий - это химический элемент с атомным номером 13 и обозначением Al. Он является лёгким, хорошо проводящим тепло и электричество металлом. Однако его химические свойства делают его уникальным и востребованным во многих отраслях промышленности.
Алюминий обладает высокой реактивностью и хорошо взаимодействует с другими элементами. В частности, он реагирует с водой и кислородом, образуя оксид алюминия (Al2O3) - стабильный оксид, который образует тонкую защитную плёнку на его поверхности. Это позволяет алюминию быть стойким к окислению и коррозии.
Ещё одной интересной особенностью алюминия является его способность формировать соединения с разными элементами, такими как хлор, сера и фосфор. Эти соединения обладают различными свойствами и используются в различных отраслях промышленности.
Алюминий также обладает свойствами амфотерного оксида, что означает его способность взаимодействовать как с кислотами, так и с щелочами. Это делает его незаменимым в процессах нейтрализации и регулирования pH.
Кроме того, алюминий обладает высокой теплоёмкостью и низкой электропроводностью, что делает его идеальным материалом для использования в электротехнике и строительных конструкциях.
В целом, химические свойства алюминия делают его универсальным и незаменимым материалом во многих отраслях промышленности, от авиации и автомобилестроения до упаковочной и пищевой промышленности.
Вопрос-ответ

Почему атом алюминия имеет 3 электрона на внешнем уровне?
Атом алюминия обладает электронной конфигурацией 1s2 2s2 2p6 3s2 3p1. Это означает, что на его внешнем энергетическом уровне (в зоне p) находится 3 электрона. Это объясняется строением энергетических уровней и правилами заполнения электронных оболочек.
Какова причина наличия 3-х электронов на внешнем энергетическом уровне атуа металла алюминия?
Количество электронов на внешнем энергетическом уровне атома металла алюминия определяется его электронной конфигурацией. В случае алюминия, его электронная конфигурация - 1s2 2s2 2p6 3s2 3p1. Отсюда следует, что на внешнем энергетическом уровне находится 3 электрона.
