Взаимодействие галогенов с щелочными металламии представляет собой важное исследовательское поле в химии. Галогены (фтор, хлор, бром, йод) и щелочные металлы (литй, натрий, калий, рубидий, цезий) обладают высокой активностью и могут образовывать разнообразные химические соединения. Анализ характеристик и механизмов таких взаимодействий позволяет лучше понять физико-химические свойства этих элементов и применить полученные знания в различных областях, таких как катализ, материаловедение и медицина.
Один из наиболее изученных аспектов взаимодействия галогенов с щелочными металлами – образование галогенидов металлов. Галогены способны образовывать с щелочными металлами множество структурно различных соединений, включая соли и комплексы. Эти вещества могут обладать разнообразными электрическими, магнитными и оптическими свойствами, проявление которых зависит от реакционных условий и структуры полученного соединения.
Изучение термодинамических и кинетических параметров реакций взаимодействия галогенов с щелочными металлами позволяет установить их степень равновесия и скорость протекания. Термодинамические данные демонстрируют, что некоторые реакции являются экзотермическими, то есть сопровождаются выделением тепла, в то время как другие реакции происходят при поглощении энергии. Кинетические исследования позволяют определить время, необходимое для завершения реакции, а также выявить факторы, влияющие на скорость протекания реакции.
Роль галогенов в взаимодействии с щелочными металлами
Взаимодействие галогенов с щелочными металлами представляет собой важную аспект в области химии. Галогены – это элементы, включающие фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и рубидий (Rb), имеют большую активность и реакционную способность, и их взаимодействие с галогенами исследуется в контексте различных химических процессов и реакций.
Галогены проявляют сильное влияние на взаимодействие с щелочными металлами. Они могут образовывать с ними хлориды, бромиды, иодиды, которые являются химически стабильными соединениями. Однако, реактивность и способность к образованию соединений с щелочными металлами различаются для каждого галогена.
Например, фтор проявляет особенную активность и образует более стабильные и сильные соединения с щелочными металлами, чем остальные галогены. Это связано с его высокой электроотрицательностью и малым размером атома. Галогениды щелочных металлов, образованные с фтором, обладают высокой теплостойкостью и стабильностью. В то же время, взаимодействие галогенов с металлами из этой группы может быть использовано для создания различных фторидов, хлоридов, бромидов и иодидов, и оно имеет важное значение в различных химических синтезах и процессах.
Таким образом, галогены играют значительную роль в взаимодействии с щелочными металлами, определяя специфические свойства и характеристики образовавшихся соединений. Понимание этой роли и различий в реактивности галогенов с щелочными металлами является важным аспектом для развития новых материалов и разработки синтезов в химической промышленности и научных исследованиях.
Физические и химические свойства галогенов
Галогены - это группа химических элементов, включающих фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). У них есть несколько общих физических и химических свойств, которые определяют их поведение и взаимодействие с другими веществами.
1. Электронная конфигурация: Галогены имеют семь электронов во внешней оболочке, что делает их очень реактивными. Они стремятся получить еще один электрон, чтобы достичь стабильной октетной конфигурации.
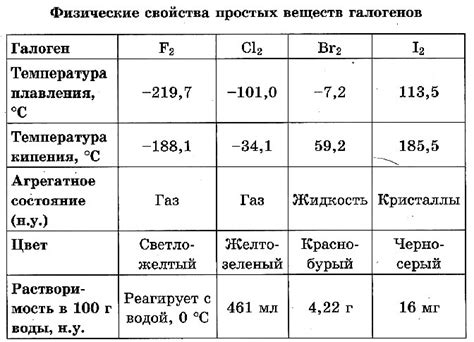
2. Физическое состояние: При комнатной температуре фтор и хлор являются газами, бром - жидкостью, а йод - твердым веществом. Галогены имеют различные цвета: фтор и хлор без цвета, бром имеет красно-коричневый цвет, а йод - фиолетовый.
3. Точка кипения и плавления: Галогены имеют низкие точки кипения и плавления. Так, фтор кипит при температуре -188 °C и плавится при -220 °C, хлор кипит при -34 °C и плавится при -101 °C, бром кипит при 59 °C и плавится при -7 °C, йод кипит при 184 °C и плавится при 114 °C.
4. Растворимость: Галогены хорошо растворяются в органических растворителях, таких как этанол и ацетон, а также в воде. Растворы галогенов имеют характерные запахи и вкусы.
5. Химическая активность: Галогены являются сильными окислителями и могут реагировать с многими другими элементами. Они образуют соли с щелочными металлами, образуют кислоты с водородом и могут образовывать сложные соединения со многими органическими веществами.
6. Ядовитость: В чистом виде галогены имеют высокую ядовитость. Фтор является наиболее токсичным из всех галогенов, причиной его ядовитости является его реактивность и электронная конфигурация.
В целом, галогены - это важные химические элементы, которые играют роль во многих химических реакциях и процессах. Их физические и химические свойства определяют их уникальное поведение и их использование в различных областях науки и технологии.
Свойства щелочных металлов

Щелочные металлы - это элементы, которые относятся к первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть ряд характерных свойств.
1. Высокая химическая активность. Щелочные металлы легко реагируют с другими веществами, особенно с кислородом и водой, что делает их опасными при хранении и обращении.
2. Амфотерность оксидов. Оксиды щелочных металлов обладают свойствами оснований, поэтому растворены в воде они дают щелочные растворы. Однако при растворении в кислотах они проявляют свойства кислот.
3. Высокая электропроводность. Щелочные металлы обладают высокой электропроводностью как твердыми веществами, так и в расплавленном состоянии, благодаря легко движущимся электронам в их кристаллической решетке.
4. Образование сильнощелочных гидроксидов. Щелочные металлы взаимодействуют с водой, образуя щелочные (основные) гидроксиды. Гидроксиды этих металлов обладают сильной щелочной реакцией, хорошо растворяются в воде и образуют растворы с высоким pH.
5. Образование солей. Щелочные металлы реагируют с кислотами, образуя соли. Полученные соли, например, нитраты, хлориды и сульфаты, находят широкое применение в различных областях, включая промышленность, медицину и сельское хозяйство.
Взаимодействие галогенов с щелочными металлами
Галогены - это группа элементов, включающая фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Щелочные металлы - это элементы первой группы периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Взаимодействие галогенов с щелочными металлами происходит в результате образования солей.
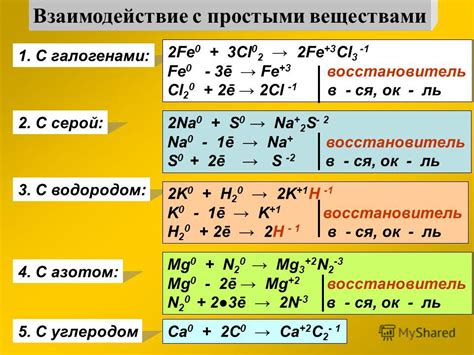
Взаимодействие галогенов с щелочными металлами основано на обмене электронами. Галогены обладают высокой электроотрицательностью, что позволяет им привлекать электроны отщепленные от щелочных металлов. В результате образуется ионная связь, при которой галоген становится отрицательным ионом (анионом), а щелочный металл - положительным ионом (катионом).
Взаимодействие галогенов с щелочными металлами происходит с выделением значительного количества тепла и света. Это явление называется эндотермической реакцией. За счет этого свойства галогены, такие как йод или бром, используются в аварийных светильниках и сигнальных ракетах.
Соли, образующиеся в результате взаимодействия галогенов с щелочными металлами, обладают высокой стабильностью и широким спектром применения. Например, хлорид натрия используется в пищевой промышленности в качестве добавки E-508, а йодид калия применяется как антисептическое средство.
Влияние взаимодействия между галогенами и щелочными металлами на химические реакции

Взаимодействие галогенов с щелочными металлами является одной из важных областей исследования в химии. Галогены, такие как фтор, хлор, бром и йод, являются высокоактивными элементами, а щелочные металлы – такие как литий, натрий, калий и др. – обладают высокой электроотрицательностью. Взаимодействие между ними может приводить к различным химическим реакциям и образованию соединений, которые могут иметь важное промышленное и научное значение.
Взаимодействие галогенов с щелочными металлами может приводить к образованию солей и галогенидов, которые являются важными компонентами многих химических продуктов. Соли щелочных металлов являются основными ингредиентами многих пищевых добавок, лекарственных препаратов, бытовой химии и т.д. Например, натриевая соль, или поваренная соль, является неотъемлемой частью нашей диеты. Галогениды щелочных металлов, такие как калиев бромид или натриев йодид, применяются в фотографии, медицине и других отраслях промышленности.
Взаимодействие галогенов с щелочными металлами может также влиять на скорость реакций и их продукты. Часто галогены выступают в качестве окислителей, а щелочные металлы – в качестве восстановителей в химических реакциях. Например, реакция хлора с натрием может привести к образованию натриевого хлорида и освобождению энергии, что может приводить к взрывоопасным ситуациям в промышленности.
Взаимодействие галогенов с щелочными металлами также может влиять на полупроводниковые свойства материалов. Галогениды щелочных металлов могут быть использованы в производстве электронных устройств, таких как светодиоды и солнечные батареи. Это обусловлено их способностью модифицировать электронную структуру материалов и повышать их проводимость.
Вопрос-ответ

Какие галогены взаимодействуют с щелочными металлами?
С щелочными металлами взаимодействуют все галогены: фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At).
Какие соединения образуются при взаимодействии галогенов с щелочными металлами?
При взаимодействии галогенов с щелочными металлами образуются галогениды щелочных металлов. Например, образование галогенида натрия (NaCl), галогенида калия (KBr) и т. д.
Какова природа взаимодействия галогенов с щелочными металлами?
Взаимодействие галогенов с щелочными металлами основано на обмене электронами между атомами. Галогены имеют высокую электроотрицательность и приманка для электронов, в то время как щелочные металлы имеют низкую электроотрицательность и готовы отдать свои электроны. Это приводит к образованию ионных связей между галогенидами и щелочными металлами.
Для чего используются галогениды щелочных металлов?
Галогениды щелочных металлов широко применяются в различных областях. Например, хлорид натрия (NaCl) используется в пищевой промышленности как поваренная соль, бромид калия (KBr) используется в фотографии, а йодид калия (KI) используется в медицине в качестве антисептика и лекарства от щитовидной железы.
