Металлы — это класс химических элементов, которые обладают рядом уникальных свойств. Одним из таких свойств является их амфотерный характер, то есть способность металлов проявлять и кислотные, и щелочные свойства. Это отличает их от других классов элементов, таких как неметаллы или полуметаллы.
Амфотерность металлов возникает из-за специфической структуры и электронной конфигурации их атомов. В результате, металлы способны взаимодействовать как с кислотами (субстанциями, способными отдавать протоны), так и с щелочами (субстанциями, способными принимать протоны). Благодаря этому, металлы могут реагировать с разными химическими соединениями и проявлять свои амфотерные свойства в различных средах.
Примерами металлов, проявляющих амфотерный характер, являются алюминий (Al), цинк (Zn) и свинец (Pb). Алюминий способен реагировать с щелочами, образуя алюминаты, а также с кислотами, образуя алюминийсоли. Цинк может образовывать гидроксиды в щелочных средах и кислородные соединения в кислотных средах. Свинец проявляет амфотерные свойства во многих реакциях, так как способен взаимодействовать как с кислотами, так и с щелочами.
Металлы проявляют амфотерный характер: особенности и примеры

Амфотерный характер металлов означает, что они могут образовывать как кислотные, так и основные соединения в реакциях с различными компонентами.
Проявление амфотерного характера зависит от свойств электронной структуры металлов. Они обладают свободными электронами, которые могут участвовать в образовании химических связей. Это позволяет металлам реагировать с различными кислотами и основаниями.
Одним из примеров металлов, проявляющих амфотерный характер, является алюминий. Он может реагировать как с кислотами, например, солями, образуя соединения, так и с основаниями, образуя гидроксид алюминия. Также, алюминий может действовать как катализатор при реакциях окисления-восстановления.
Еще одним примером металла с амфотерным характером является цинк. Он может реагировать как с кислотами, образуя соли, так и с основаниями, образуя гидроксид цинка. Цинк также проявляет свои амфотерные свойства при взаимодействии с аммиаком и гидроксидом натрия.
Амфотерный характер металлов имеет большое значение в химической промышленности и в различных технологических процессах. Это свойство позволяет металлам быть универсальными и эффективными реагентами в различных химических реакциях.
Описание амфотерности металлов
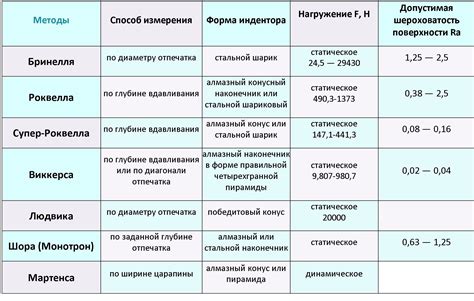
Амфотерные металлы - это класс химических элементов, которые могут проявлять как кислотные, так и щелочные свойства в различных химических реакциях. Эти металлы могут образовывать ионы как с положительным, так и с отрицательным зарядом, взаимодействуя с различными кислотами и щелочами.
Одной из важных особенностей амфотерных металлов является способность взаимодействия с водой. Под влиянием воды эти металлы образуют щелочные оксиды или гидроксиды, а также кислотные оксиды или ангидриды. Например, алюминий, который является амфотерным металлом, реагирует с водой и образует щелочной гидроксид алюминия и кислотный оксид алюминия.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), медь (Cu) и др. Амфотерность этих металлов определяется их структурой и позицией в периодической системе элементов. Например, амфотерность железа объясняется наличием двух различных оксидов: FeO, который проявляет свойства щелочного оксида, и Fe2O3, который проявляет свойства кислотного оксида.
Амфотерные металлы имеют широкое применение в различных областях науки и техники. Они используются в производстве различных сплавов, катализаторов, косметических средств, ионно-обменных смол и многих других продуктов. Амфотерность металлов является важным свойством, которое позволяет им проявлять разнообразные химические свойства и находить применение в различных процессах и производствах.
Примеры металлов с амфотерным характером

Алюминий является одним из наиболее известных примеров металлов с амфотерным характером. Он образует соединения с кислотами и щелочами, проявляя свою амфотерность. Например, при реакции с кислотами алюминий образует соли алюмината и выделяет водород, а при реакции с щелочами образует соли алюмината и выделяет аммиак.
Еще одним примером металла с амфотерным характером является цинк. Он также образует соединения с кислотами и щелочами, проявляя свою амфотерность. Например, цинк реагирует с кислотами, образуя соли цинката и выделяет водород, а также реагирует с щелочами, образуя соли цинката и выделяет аммиак.
Кроме того, металл свинец также проявляет амфотерный характер. Он может образовывать соединения как с кислотами, так и с щелочами. Например, свинец реагирует с кислотами, образуя соли свинца и выделяет водород, а также реагирует с щелочами, образуя соли свинца и выделяет аммиак.
Также стоит упомянуть металлы, такие как железо, медь и никель, которые также обладают амфотерным характером. Они могут образовывать соединения как с кислотами, так и с щелочами, проявляя свою амфотерность.
Вопрос-ответ

Какие металлы являются амфотерными?
Амфотерными металлами являются, например, алюминий, цинк, свинец и олово.
Что значит, что металлы проявляют амфотерный характер?
Амфотерный характер проявляется в том, что эти металлы могут взаимодействовать как с кислотами, так и с основаниями.
Какие реакции происходят при взаимодействии амфотерных металлов с кислотами?
При взаимодействии амфотерных металлов с кислотами образуются соли металла и выделяется водород.
Какие реакции происходят при взаимодействии амфотерных металлов с основаниями?
При взаимодействии амфотерных металлов с основаниями образуются соли металла и выделяется вода.
