Амфотерные оксиды - это класс соединений, которые могут проявлять и кислотные, и основные свойства. Такие оксиды претерпевают реакции с кислотами и основаниями, образуя соли или соединения с основаниями. Это свойство обусловлено наличием в их структуре активных атомов, которые могут образовывать химические связи с различными веществами.
Металлы, которые способны образовывать амфотерные оксиды, включают алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), марганец (Mn) и их соединения. Важно отметить, что не все оксиды этих металлов являются амфотерными - только некоторые из них проявляют такое свойство.
Амфотерные оксиды обладают широким спектром применений. Например, оксид алюминия (Al2O3) используется в производстве керамики, стекла и катализаторов. Оксид цинка (ZnO) применяется в косметической и фармацевтической промышленности, а также в производстве каучука и пластмасс.
Важно помнить, что химические свойства металлов и их оксидов тщательно изучаются и имеют важное значение в различных отраслях науки и промышленности.
Исследование амфотерных оксидов позволяет лучше понять их реакционную способность и потенциальное влияние на окружающую среду. Этот класс соединений представляет интерес для развития новых материалов и технологий, а также для решения практических проблем в различных областях, таких как энергетика, электроника и экология.
Амфотерные оксиды палладия и свинца

Амфотерные оксиды – это соединения, которые имеют способность реагировать как с кислотными, так и с щелочными реагентами. Среди разнообразных металлических оксидов некоторые элементы, такие как палладий и свинец, обладают амфотерными свойствами.
Оксид палладия (PdO) является амфотерным оксидом, который проявляет свою активность как в кислых, так и в щелочных средах. В кислотных условиях оксид палладия растворяется, образуя палладиевую кислоту, а в щелочных условиях образует гидроксид палладия. Это свойство позволяет использовать оксид палладия в качестве катализатора в различных химических реакциях.
Свинцовый оксид (PbO) также является амфотерным оксидом. В кислотных условиях свинцовый оксид растворяется, образуя соли свинца, а в щелочных условиях образует гидроксид свинца. Свинцовый оксид широко применяется в производстве стекла, электродов и других материалов.
Соединения палладия и свинца, образующие амфотерные оксиды, являются важными компонентами в различных технических и промышленных процессах. Их амфотерные свойства позволяют использовать эти материалы в различных областях, включая катализаторы, электроды и материалы для производства стекла. Оксиды палладия и свинца играют значительную роль в развитии современных технологий и находят применение во многих отраслях промышленности.
Особенности формирования оксидов
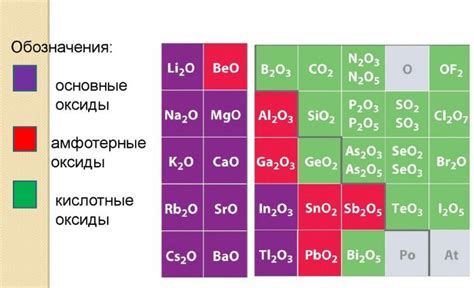
Амфотерные оксиды образуются многими металлами и имеют способность реагировать как с кислотами, так и с основаниями. Это связано с исключительной химической активностью этих соединений.
Наиболее известным примером амфотерного оксида является оксид алюминия (Al2O3), который проявляет свойства как кислоты, так и основания в различных химических реакциях. Например, он способен взаимодействовать с сильными щелочами и образовывать соли, а также реагировать с кислотами, образуя с ними соли алюминия.
Другим примером амфотерного оксида является оксид цинка (ZnO), который образует щелочные растворы, взаимодействуя с водой и образуя гидроксид цинка (Zn(OH)2). Однако, при реакции с кислотами он образует соли цинка.
В таблице приведены основные амфотерные оксиды и их свойства:
| Металл | Оксид | Свойства |
|---|---|---|
| Алюминий | Al2O3 | Амфотерный, образует соли алюминия |
| Цинк | ZnO | Амфотерный, образует соли цинка |
| Свинец | PbO | Амфотерный, образует соли свинца |
Таким образом, формирование амфотерных оксидов является особенностью некоторых металлов, которая определяет их реакционную способность и взаимодействие с другими веществами.
Металлы, способные образовывать амфотерные оксиды
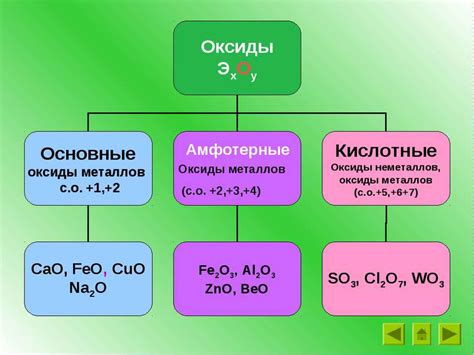
Амфотерные оксиды – особый класс соединений, которые реагируют как с кислотами, так и с щелочами. Некоторые металлы способны формировать такие соединения благодаря особенностям их электронной структуры.
Один из самых известных амфотерных металлов – это алюминий (Al). Амфотерный оксид алюминия (Al2O3) может реагировать как с кислотами, образуя соли, так и с щелочами, образуя алюминаты. Эта способность связана с наличием координационного числа 6 у алюминия, что дает возможность образования стабильных комплексов.
Еще одним примером металла, образующего амфотерные оксиды, является цинк (Zn). Цинковый оксид (ZnO) может реагировать как с кислотами, например с соляной кислотой (HCl), образуя соли цинка, так и с щелочами, например с гидроксидом натрия (NaOH), образуя цинкат натрия.
Среди других металлов, способных формировать амфотерные оксиды, можно назвать такие элементы, как свинец (Pb), железо (Fe), германий (Ge) и кадмий (Cd). Каждый из этих металлов образует соединения с амфотерными свойствами, которые могут проявляться в реакциях как с кислотами, так и с щелочами.
Примеры металлов, образующих амфотерные оксиды
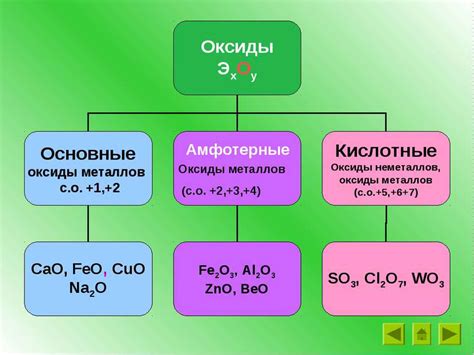
Амфотерные оксиды — это соединения, которые могут образовывать кислотные и основные реакции. Такие соединения обладают свойством реагировать как с кислотами, так и с основаниями, в зависимости от условий окружающей среды.
Одним из примеров металлов, образующих амфотерные оксиды, является алюминий (Al). Оксид алюминия (Al2O3) обладает кислотными свойствами при реакции с щелочами, образуя соли алюмината. Однако в реакции с кислотами оксид алюминия действует как основание, образуя алюминаты. Это свойство алюминия делает его важным компонентом в производстве алюминиевых солей и катализаторов.
Свинец (Pb) также является металлом, образующим амфотерные оксиды. Оксид свинца (PbO) представляет собой ярко-желтое вещество, которое реагирует как с кислотами, так и с основаниями. В реакции с кислотами оксид свинца действует как основание, образуя соли свинцовой кислоты. Но при взаимодействии с щелочами оксид свинца ведет себя как кислота, образуя соединения типа плумбатов.
Цинк (Zn) — еще один пример металла, способного образовывать амфотерные оксиды. Оксид цинка (ZnO) проявляет кислотные свойства при реакции с щелочами, образуя цинкаты. В то же время, в реакции с кислотами оксид цинка ведет себя как основание, образуя цинкаты. Из-за своих амфотерных свойств оксид цинка широко используется в производстве лаков, керамических материалов и солнцезащитных кремов.
Роль амфотерных оксидов в химических реакциях

Амфотерные оксиды - это соединения металлов, которые проявляют кислотные и основные свойства в зависимости от условий окружающей среды. Такие оксиды считаются универсальными соединениями, которые могут реагировать как с кислотами, так и с основаниями.
В химических реакциях амфотерные оксиды играют важную роль. Они могут участвовать в протонных реакциях, в которых выступают как кислоты или основания, приобретая или отдавая протоны. Также амфотерные оксиды способны взаимодействовать с другими веществами, образуя сложные соединения.
Амфотерные оксиды могут реагировать с кислотами, принимая на себя протоны и образуя соли. Например, оксид алюминия (Al2O3) взаимодействует с соляной кислотой (HCl), образуя соль алюминия и воду:
- Al2O3 + 6HCl → 2AlCl3 + 3H2O
Амфотерные оксиды также могут реагировать с основаниями, образуя соединения, называемые амфотерными гидроксидами. Например, оксид цинка (ZnO) взаимодействует с натриевым гидроксидом (NaOH), образуя амфотерный гидроксид цинка:
- ZnO + 2NaOH → Na2ZnO2 + H2O
Амфотерные оксиды играют важную роль в промышленности и технологии. Например, оксид алюминия используется в производстве керамики, стекол, алюминиевой фольги, а осажденные оксиды металлов применяются в качестве катализаторов, адсорбентов и электролитов.
Вопрос-ответ

Какие металлы образуют амфотерные оксиды?
Амфотерные оксиды образуют металлы, которые могут образовывать соединения как с кислотами, так и с основаниями. Примерами таких металлов являются алюминий, германий, свинец, висмут и другие.
Какие свойства обладают амфотерные оксиды?
Амфотерные оксиды обладают способностью проявлять свойства как кислоты, так и основания, то есть реагировать и с кислотами, и с основаниями. Это связано с тем, что они могут образовывать как ионные связи с присутствующими в растворе ионами, так и ковалентные связи.
Как происходит реакция амфотерных оксидов с кислотами?
При реакции амфотерных оксидов с кислотами образуется соль и вода. Амфотерные оксиды выступают в этой реакции в роли оснований, принимая протоны от кислоты и образуя положительно заряженные ионы. Таким образом, происходит нейтрализация кислоты и образование соли.
Как происходит реакция амфотерных оксидов с основаниями?
При реакции амфотерных оксидов с основаниями образуется соль и вода. Амфотерные оксиды действуют в данной реакции в роли кислоты, отдавая протоны основанию и образуя отрицательно заряженные ионы. Таким образом, происходит нейтрализация основания и образование соли.
