Амфотерные металлы являются особой группой элементов, которые могут проявлять свойства как металлов, так и неметаллов в разных условиях. Это означает, что они способны выделять электроны и электрохимически взаимодействовать как с кислотами, так и с щелочами.
Основными характеристиками амфотерных металлов являются их способность образовывать ионы разного заряда в реакциях с кислотными и основными соединениями. Например, в реакции с кислотами амфотерные металлы образуют положительно заряженные ионы металла, а в реакции с основными соединениями - отрицательно заряженные ионы металла.
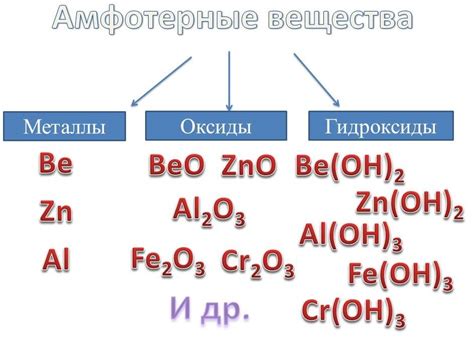
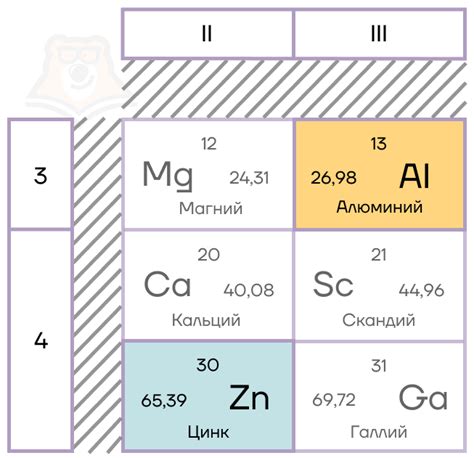
Примерами амфотерных металлов являются алюминий, железо, цинк и олово. Алюминий, например, образует ионы Al^3+ и Al(OH)^4-, в зависимости от условий реакции. В реакции с кислотой, он образует ион Al^3+, а с щелочью - ион Al(OH)^4-. Таким образом, алюминий проявляет амфотерные свойства и может реагировать как с кислотами, так и с основаниями.
Амфотерные металлы: общая информация
Амфотерными металлами называются вещества, которые могут проявлять как кислотные, так и основные свойства в различных реакциях. Они обладают способностью реагировать и взаимодействовать с кислотами и основаниями, изменяя свою степень окисления.
Важной характеристикой амфотерных металлов является наличие свободных электронов в своей внешней электронной оболочке, что позволяет им участвовать в реакциях обмена электронами. Это означает, что они могут принимать или отдавать электроны, в зависимости от условий реакции.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), никель (Ni) и др. Эти металлы могут образовывать соединения со свойствами как кислоты, так и основания в зависимости от реагентов, с которыми они взаимодействуют.
Амфотерные металлы обладают широким спектром применений в различных областях, включая производство стали, электротехнику, химическую промышленность и др. Изучение их свойств и реакций является важным аспектом химической науки и позволяет разрабатывать новые материалы и процессы.
Свойства амфотерных металлов
Амфотерные металлы - это группа химических элементов, которые могут проявлять свойства и характеристики как кислот, так и оснований. Это значит, что они могут реагировать с кислотами и образовывать соли, а также реагировать с основаниями и образовывать гидроксиды.
Одним из самых известных амфотерных металлов является алюминий. Он может реагировать как с кислотами, так и с основаниями. В реакции с кислотами алюминий образует соли, например, алюминий хлорид AlCl3 или алюминий сульфат Al2(SO4)3. В реакции с основаниями он образует гидроксид алюминия, Al(OH)3.
Еще одним примером амфотерного металла является цинк. Он также может образовывать соли с кислотами и гидроксид с основаниями. Например, цинксульфат ZnSO4 - соль, образованная в результате реакции цинка с серной кислотой, и гидроксид цинка Zn(OH)2 - образуется в реакции цинка с гидроксидом натрия.
Еще одним хорошим примером амфотерных металлов являются медь и свинец. Оба металла проявляют свойства и кислот и оснований и образуют соответствующие соли и гидроксиды. Например, медь может реагировать с серной кислотой и образовывать медь(II)сульфат CuSO4 или реагировать с гидроксидом натрия и образовывать гидроксид меди Cu(OH)2.
Таким образом, свойства амфотерных металлов позволяют им проявлять реакции и с кислотами, и с основаниями, что делает их универсальными в химических процессах и обуславливает их широкое применение в различных отраслях промышленности и научных исследованиях.
Примеры амфотерных металлов

Амфотерные металлы - это металлы, которые могут реагировать как с кислотами, так и с основаниями, проявляя амфотерные свойства. Они обладают способностью образовывать ионы с различной степенью окисления и способностью вступать в реакции с различными реагентами.
Примером амфотерного металла является алюминий (Al), который может реагировать как с кислотами, так и с основаниями. При реакции с кислотами алюминий образует соли, например, алюминий солянокислый (Al(HSO4)3). При реакции с основаниями алюминий образует гидроксиды, например, алюминий гидроксид (Al(OH)3).
Другим примером амфотерного металла является цинк (Zn). Он может реагировать как с кислотами, так и с основаниями. При реакции с кислотами цинк образует соли, например, цинк сульфат (ZnSO4). При реакции с основаниями цинк образует гидроксиды, например, цинк гидроксид (Zn(OH)2).
Также можно привести пример свинца (Pb), который относится к амфотерным металлам. Он может образовывать соли при реакции с кислотами, например, свинца солянокислый (Pb(HSO4)2). При реакции с основаниями свинец образует гидроксиды, например, свинец гидроксид (Pb(OH)2).
Реакция амфотерных металлов с кислотами

Амфотерные металлы способны реагировать не только с основаниями, но и с кислотами. Это группа металлов, которые проявляют свою амфотерность благодаря специфической электронной структуре своих атомов.
В реакции амфотерных металлов с кислотами происходит образование солей и выделение водорода. Это происходит потому, что амфотерные металлы способны выступать в качестве доноров электронов, образуя положительно заряженные ионы, которые притягивают отрицательно заряженные ионы кислоты. Оксиды реагируют с водой и образуют гидроксиды амфотерных металлов, которые далее реагируют с кислотами.
Примерами реакции амфотерных металлов с кислотами являются реакции оксидов и гидроксидов алюминия. Если взять оксид алюминия Al2O3, и его добавить к кислоте, например, серной H2SO4, произойдет образование соли алюминия и выделение молекулярного водорода: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O.
Также, амфотерным металлом является цинк. Он может реагировать не только с основаниями, но и с кислотами. К примеру, цинковый порошок Zn и серная кислота H2SO4 могут взаимодействовать, образуя соль цинка и высвобождая молекулярный водород: Zn + H2SO4 = ZnSO4 + H2.
Реакция амфотерных металлов с сильными кислотами

Амфотерные металлы - это элементы, которые могут проявлять как кислотные, так и основные свойства в различных химических реакциях. Реакция этих металлов с сильными кислотами является одной из таких характеристик.
При взаимодействии амфотерных металлов с сильными кислотами происходит образование соли и выделение газа. Это происходит за счет обменных реакций, при которых ионы металла замещают ионы водорода в кислоте.
Примером такой реакции может служить взаимодействие алюминия с соляной кислотой (HCl). При этом образуется соль - хлорид алюминия (AlCl3), а освобождающийся газ - водород (H2).
Аналогичные реакции могут происходить и с другими амфотерными металлами, такими как цинк, свинец, железо и др. Все они способны проявлять кислотные свойства при взаимодействии со сильными кислотами.
Реакция амфотерных металлов с слабыми кислотами

Амфотерные металлы являются универсальными веществами, которые могут реагировать как с кислотами, так и с основаниями. Реакция амфотерных металлов с слабыми кислотами является одним из проявлений их амфотерности.
Когда амфотерный металл вступает в реакцию с слабой кислотой, он действует как основание, принимая на себя протон от кислоты. Это взаимодействие происходит благодаря присутствию на поверхности металла активных центров, способных связываться с кислотными частицами.
Примером реакции амфотерного металла с слабой кислотой является реакция алюминия (Аl) с уксусной кислотой (CH3COOH). В результате этой реакции образуется соль алюминия и выделяется водород. Уравнение реакции выглядит следующим образом:
2Al + 2CH3COOH → 2CH3COOAl + H2
Таким образом, амфотерные металлы проявляют свою способность реагировать с слабыми кислотами, образуя соли и выделяя водород. Это одно из множества проявлений их амфотерности.
Реакция амфотерных металлов с основаниями
Амфотерные металлы проявляют способность реагировать как с кислотными, так и с основными веществами. Реакция амфотерных металлов с основаниями включает образование солей и выделение газа или воды.
Один из примеров такой реакции - взаимодействие цинка (Zn) с гидроксидом натрия (NaOH). При этом цинк образует соль - гидроксид цинка (Zn(OH)2), а также образуется аммиак (NH3), который выделяется в виде газа.
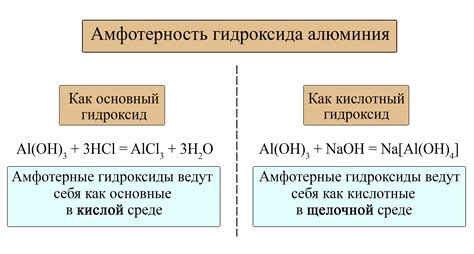
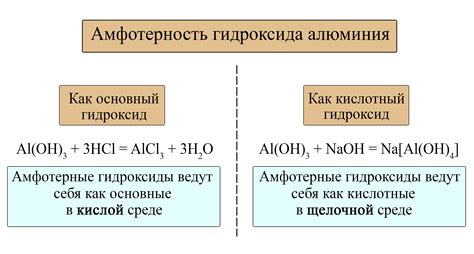
Еще одним примером реакции амфотерного металла с основанием является реакция алюминия (Al) с гидроксидом калия (KOH). В результате образуется соль - гидроксид алюминия (Al(OH)3) и выделяется вода (H2O).
Реакция амфотерных металлов с основаниями может также включать образование осадков. Например, взаимодействие свинца (Pb) с гидроксидом натрия (NaOH) приводит к образованию осадка - гидроксида свинца (Pb(OH)2), который является нерастворимым в воде.
Реакция амфотерных металлов с сильными основаниями

Амфотерные металлы способны проявлять свои амфотерные свойства в реакции как с кислотами, так и с основаниями. В данном случае речь пойдет о реакции амфотерных металлов с сильными основаниями.
Сильные основания, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), обладают высокой щелочностью и активно реагируют с амфотерными металлами.
При взаимодействии амфотерного металла с сильным основанием, образуется соответствующий гидроксид металла и соль. Например, реакция амфотерного металла алюминия (Al) с гидроксидом натрия (NaOH) приводит к образованию гидроксида алюминия (Al(OH)3) и соли, такой как натрий алюминат (NaAlO2).
Данная реакция можно представить схематически:
| Реагенты | Продукты |
|---|---|
| Al + NaOH | Al(OH)3 + NaAlO2 |
Аналогично, амфотерные металлы, такие как цинк (Zn) и олово (Sn), также могут реагировать с сильными основаниями и образовывать соответствующие гидроксиды и соли.
Таким образом, реакция амфотерных металлов с сильными основаниями приводит к образованию гидроксидов металлов и солей, что является одним из проявлений их амфотерности.
Реакция амфотерных металлов с слабыми основаниями
Амфотерные металлы - это металлы, которые могут реагировать как с кислотами, так и с основаниями. Они обладают способностью образовывать соли и гидроксиды и проявляют различные свойства при взаимодействии с разными реагентами. В случае реакции с слабыми основаниями, амфотерные металлы проявляют свое кислотное поведение.
При реакции амфотерных металлов с слабыми основаниями, такими как гидроксиды аммония или аминов, образуются соответствующие соли и вода. Например, реакция оксида алюминия (Al2O3) с гидроксидом аммония (NH4OH) приводит к образованию соли алюминия (AlNH4) и воды:
Al2O3 + 6NH4OH → 2AlNH4 + 3H2O
Подобным образом реагируют и другие амфотерные металлы, такие как цинк (Zn), свинец (Pb) и бериллий (Be), с различными слабыми основаниями. В таких реакциях образуются соли амфотерных металлов и вода.
Реакция амфотерных металлов с слабыми основаниями является важным процессом в химии и имеет широкое применение. Например, амфотерные металлы используются в процессе нейтрализации кислотных или щелочных растворов, а также в производстве различных химических соединений.
Вопрос-ответ

Какие металлы относятся к амфотерным, и что это означает?
К амфотерным металлам относятся металлы, которые могут проявлять как кислотные, так и основные свойства. Это включает такие металлы, как алюминий, свинец, цинк, железо, кобальт и другие. Они способны реагировать с кислотами, основаниями и оксидами.
Какую роль играют амфотерные металлы в растворах?
Амфотерные металлы могут выступать и в роли окислителей и в роли восстановителей в растворах. Они могут принимать на себя электроны от веществ, которые имеют большую электроотрицательность, и передавать электроны веществам с меньшей электроотрицательностью.
Какие реакции между амфотерными металлами и кислотами возможны?
Амфотерные металлы могут реагировать с кислотами, образуя соли и выделяя водород. Например, алюминий реагирует с соляной кислотой, образуя хлорид алюминия и выделяя водород. Амфотерные металлы также могут реагировать с кислотами, образуя комплексные соединения.
Какие реакции между амфотерными металлами и основаниями возможны?
Амфотерные металлы могут реагировать с основаниями, образуя соли и воду. Например, алюминий может реагировать с гидроксидом натрия, образуя алюминат натрия и выделяя воду. Они также могут реагировать с основаниями, образуя комплексные соединения.
