Амфотерные металлы - это вещества, которые могут проявлять свойства как оснований, так и кислот. Это означает, что они способны реагировать как с кислотами, так и с основаниями, образуя с ними соли. Такие металлы обладают особыми химическими свойствами, которые исследуются в рамках курса химии в 9 классе.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn) и свинец (Pb), а также их ионы в различных степенях окисления. Отличительной особенностью амфотерных металлов является наличие свободных электронов в внешней электронной оболочке, благодаря которым они могут проявлять кислотные или основные свойства.
Реакция амфотерного металла с кислотой проявляется в образовании соли и выделении водорода. В то же время, реакция амфотерного металла с основанием приводит к образованию соли и воды. Это свойство амфотерных металлов позволяет им играть важную роль в регулировании кислотно-основного баланса в различных химических процессах.
Изучение свойств амфотерных металлов в химии 9 класса позволяет ученикам более глубоко понять основные принципы химических реакций и взаимодействий между различными веществами. Это знание имеет практическое применение в реальной жизни и может быть использовано в различных областях, включая медицину, промышленность и науку.
Определение амфотерных металлов

Амфотерные металлы - это класс веществ, которые могут проявлять как свойства щелочей, так и свойства кислот. Они образуют соли как с кислотами, так и с щелочами, а также могут вступать в реакцию с водой и образовывать соответствующие гидроксиды.
Этот класс металлов включает в себя такие элементы, как алюминий (Al), цинк (Zn), железо (Fe), свинец (Pb), марганец (Mn) и другие. Эти металлы обладают способностью менять свою окислительную способность в зависимости от условий реакции.
Амфотерные металлы обычно реагируют с кислотами, образуя соответствующие соли. Например, алюминий реагирует с соляной кислотой в результате чего образуется алюминий хлорид (AlCl3). Также эти металлы могут реагировать с щелочами, образуя гидроксиды, например, железо реагирует с гидроксидом натрия и образует гидроксид железа (III) (Fe(OH)3).
Однако, стоит отметить, что реакция амфотерных металлов с кислотами и щелочами протекает по-разному. С кислотами они реагируют, образуя соли, а с щелочами - гидроксиды. Это связано с различием в механизмах реакций и окислительных свойствах этих веществ.
Химические свойства амфотерных металлов
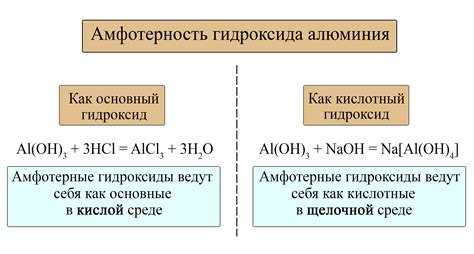
Амфотерные металлы – это класс элементов, которые могут реагировать как с кислотами, так и с основаниями. Они способны образовывать соли с обоими классами веществ в зависимости от условий реакции.
Одним из основных примеров амфотерного металла является алюминий (Al). Этот элемент образует гидроксид алюминия (Al(OH)3), который может действовать как слабая кислота или слабое основание в различных реакциях. Например, раствор гидроксида алюминия (Al(OH)3) образует алюминаты сильных оснований и алюминиевые соли сильных кислот.
Еще одним примером амфотерного металла является цинк (Zn). Вода реагирует с цинком и образует гидроксид цинка (Zn(OH)2), который также может действовать как слабая кислота или слабое основание.
Амфотерные металлы играют важную роль в различных химических процессах и реакциях. Их свойства позволяют им взаимодействовать с различными классами веществ и участвовать в формировании сложных соединений и соединений с переменной степенью окисления.
Таблица ниже показывает амфотерные металлы и некоторые их свойства:
| Металл | Примеры соединений |
|---|---|
| Алюминий (Al) | Гидроксид алюминия (Al(OH)3), сульфат алюминия (Al2(SO4)3) |
| Цинк (Zn) | Гидроксид цинка (Zn(OH)2), нитрат цинка (Zn(NO3)2) |
| Свинец (Pb) | Гидроксид свинца (Pb(OH)2), ацетат свинца (Pb(CH3COO)2) |
Амфотерные металлы имеют широкий спектр применений в различных областях, включая промышленность, медицину и технологии. Изучение их свойств и реакций помогает улучшить понимание химии и расширить возможности использования этих металлов в различных сферах деятельности.
Реакция амфотерных металлов с кислотами

Амфотерные металлы - это металлические элементы, которые проявляют свойства и кислот, и щелочей в химических реакциях. Они могут образовывать как соли кислотных оксидов, так и соли основных оксидов в реакциях с кислотами.
Реакция амфотерных металлов с кислотами происходит в двух возможных направлениях. Во-первых, амфотерный металл может действовать как основание и образовывать соли с кислотами. Например, алюминий (Al) взаимодействует с соляной кислотой (HCl) и образует соль - хлорид алюминия (AlCl3).
Во-вторых, амфотерный металл может действовать как кислота и образовывать соли с основаниями. Например, цинк (Zn) реагирует с щелочами, такими как натрий гидроксид (NaOH), и образует соль - гидроксид цинка (Zn(OH)2).
Реакция амфотерных металлов с кислотами является важным аспектом их химических свойств. Она позволяет использовать эти металлы в различных промышленных и научных сферах, а также в повседневной жизни. Например, алюминий применяется для производства металлокерамики, а цинк используется в процессе гальванизации, при которой на металлическую поверхность покрывается защитное покрытие из цинка.
Реакция амфотерных металлов с щелочами

Амфотерные металлы - это элементы, которые могут проявлять свойства и характерные реакции как щелочных металлов, так и кислотных оксидов. Одной из особенностей амфотерных металлов является их способность реагировать с щелочами, такими как гидроксиды щелочных металлов.
При реакции амфотерных металлов с щелочами образуются соли. В зависимости от конкретной реакции, образующиеся соли могут быть кислородсодержащими или безкислородными.
Реакция амфотерных металлов с щелочами может протекать по разным сценариям. Если металл образует кислородсодержащую соль, то это свидетельствует о его способности образовывать основания. Например, алюминий при реакции с гидроксидом натрия образует соль - алюминат натрия (Na3AlO3).
Если амфотерный металл образует безкислородную соль, то это свидетельствует о его способности образовывать кислоты. Например, цинк при реакции с гидроксидом натрия образует соль - цинкат натрия (Na2ZnO2).
Таким образом, реакция амфотерных металлов с щелочами позволяет выявить характерные свойства их оксидов и проявить их амфотерность.
Ферменты и амфотерные металлы
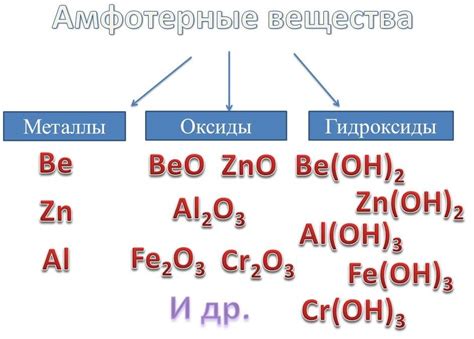
Ферменты - это специфические белки, которые играют важную роль в работе организма. Они катализируют химические реакции, ускоряя их протекание. Свойства амфотерных металлов, таких как алюминий и цинк, могут оказывать влияние на активность ферментов.
Амфотерные металлы могут образовывать ионы как с положительным, так и с отрицательным зарядом. Это означает, что они способны как принимать электроны, так и отдавать их. Взаимодействие амфотерных металлов с ферментами может изменить их активность, поскольку ферменты работают на уровне электронного транспорта и каталитических центров.
Например, амфотерный металл цинк является неотъемлемой частью активного центра некоторых ферментов, таких как карбоксипептидаза и карбоамидаза. Этот металл стабилизирует промежуточные состояния реакции и ускоряет ее протекание. Взаимодействие цинка с ферментами может изменить электронное распределение в активном центре и, соответственно, влиять на каталитическую активность ферментов.
Таким образом, свойства амфотерных металлов могут оказывать существенное влияние на работу ферментов и протекание биологических реакций. Изучение взаимодействия амфотерных металлов с ферментами позволяет глубже понять механизмы биохимических процессов в организме и разработать новые методы лечения различных заболеваний.
Использование амфотерных металлов в промышленности

Амфотерные металлы - это металлы, которые могут реагировать как с кислотными, так и с щелочными реагентами. Их уникальные свойства и возможности позволяют широко использовать их в различных отраслях промышленности.
В первую очередь, амфотерные металлы применяются в производстве электроники. Они являются важными компонентами полупроводников и суперпроводников, которые используются в создании микрочипов, транзисторов и других электронных компонентов. Амфотерные металлы обладают высокой электропроводностью и хорошей стабильностью, что делает их идеальным выбором для электронной промышленности.
Кроме того, амфотерные металлы применяются в производстве авиационной и космической техники. Они используются для создания легких и прочных материалов, которые выдерживают высокие температуры и экстремальные условия. Также амфотерные металлы используются в производстве корпусов и деталей для самолетов, ракет и спутников.
Другая область применения амфотерных металлов - производство батарей и аккумуляторов. Они обладают высокой ёмкостью и стабильной работой, что делает их незаменимыми для сохранения источников энергии. Батареи на основе амфотерных металлов используются в мобильных телефонах, ноутбуках, электромобилях и других устройствах.
Также амфотерные металлы широко применяются в химической промышленности. Они используются в процессе синтеза органических соединений и катализа реакций. Например, амфотерные металлы могут использоваться для очистки воды, удаления токсичных веществ и разработки новых лекарственных препаратов.
Итак, использование амфотерных металлов в промышленности является многообразным и важным. Они играют значительную роль в различных отраслях, обеспечивая высокую производительность и устойчивость процессов производства.
Важность изучения свойств амфотерных металлов для химии 9 класса

Изучение свойств амфотерных металлов является важным шагом в обучении химии для учащихся 9 класса. Эти металлы обладают особенными химическими свойствами, которые позволяют им взаимодействовать с различными кислотами и основаниями.
Первое, что следует отметить, это то, что амфотерные металлы проявляют свойства как металлов, так и неметаллов. Они могут образовывать оксиды, которые реагируют с водой. Таким образом, амфотерные металлы играют важную роль в реакциях окисления и восстановления.
Второе, амфотерные металлы обладают способностью взаимодействовать с различными кислотами и основаниями. Они могут образовывать соли сильных кислот и оснований, что открывает им широкие возможности в реакциях обмена.
Третье, изучение свойств амфотерных металлов позволяет учащимся разобраться в образовании комплексов. Амфотерные металлы способны образовывать комплексы не только с анионами, но и с молекулами некоторых органических соединений. Это важное знание для дальнейшего изучения химии, так как комплексы широко используются в различных промышленных процессах и в естественных системах.
Всего эти свойства амфотерных металлов дают учащимся понимание о том, как происходят химические реакции с участием этих металлов, а также о их широких применениях. Поэтому изучение свойств амфотерных металлов является неотъемлемой частью программы по химии для учащихся 9 класса.
Вопрос-ответ

Что такое амфотерные металлы?
Амфотерные металлы - это металлы, которые могут образовывать как ион положительного заряда, так и ион отрицательного заряда во время химических реакций.
Какие свойства характерны для амфотерных металлов?
Амфотерные металлы обладают способностью проявлять кислотные и основные свойства, взаимодействуя как с кислотами, так и с основаниями.
Какие металлы относятся к амфотерным?
К амфотерным металлам относятся, например, алюминий, цинк, свинец и железо.
В чем проявляется амфотерность металлов в химических реакциях?
В химических реакциях амфотерные металлы могут образовывать соли с кислотными и основными свойствами.
