Амфотерные металлы являются особым классом химических элементов, которые обладают способностью проявлять свойства не только оснований, но и кислот. Такое поведение обусловлено наличием в их атомах свободных электронов, которые могут либо принимать, либо отдавать электроны при взаимодействии с другими веществами.
Главной особенностью амфотерных металлов является возможность образования солей и ионов как положительной, так и отрицательной зарядности. Этот факт делает их уникальными соединениями и придает им значительную химическую активность.
Существуют несколько групп амфотерных металлов, включающих в себя такие элементы, как алюминий, цинк, свинец, олово и другие. Каждая группа имеет свои характерные свойства, но объединяет их общая способность проявлять амфотерное поведение.
Таким образом, амфотерные металлы представляют собой уникальный класс химических элементов, которые проявляют свойства как кислот, так и оснований. Их способность образовывать соли и ионы обеих зарядностей делает их важными с точки зрения различных химических процессов и применений в области науки и технологии.
Определение амфотерных металлов

Амфотерные металлы – это класс элементов, которые могут образовывать соли как с кислотами, так и с основаниями. Такие металлы обладают способностью проявлять свойства как металлов, так и неметаллов в зависимости от условий реакции.
Амфотерные металлы включают в себя несколько групп элементов, включая алюминий, галлий, цинк, свинец и другие. Они расположены в периодической таблице в том месте, где обычно находятся металлы.
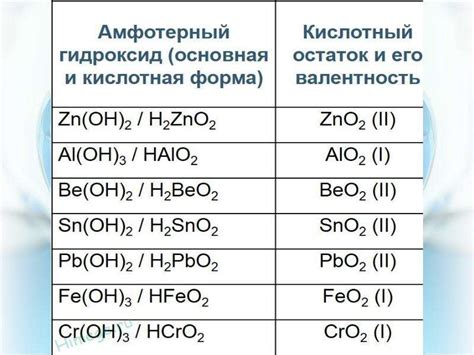
Способность амфотерных металлов образовывать как катионы, так и анионы, позволяет им реагировать как с кислотными, так и с основными реагентами. Например, алюминий может реагировать как с кислотами, образуя соли (например, алюминийсульфат), так и с основаниями, образуя гидроксид (например, оксид алюминия).
Амфотерный характер металлов обусловлен наличием свободных электронов во внешней оболочке, которые позволяют им участвовать в образовании связей с другими элементами. Это делает их не только универсальными реактивами, но и важными составляющими различных процессов в химической промышленности и в научных исследованиях.
Группа 1: амфотерные металлы переходных элементов

Амфотерные металлы переходных элементов - это группа элементов, которые могут проявлять как кислотные, так и щелочные свойства. Эти металлы могут образовывать соли и оксиды, которые растворяются как в кислотных, так и в щелочных растворах.
До этой группы относятся такие элементы, как алюминий (Al), свинец (Pb), цинк (Zn) и многие другие. Они являются важными материалами в различных отраслях промышленности и имеют широкое применение.
Амфотерные металлы переходных элементов обладают уникальными химическими свойствами, которые обуславливают их широкое использование. Например, алюминий применяется в производстве авиационной и автомобильной промышленности, а свинец используется при производстве аккумуляторов и припоев.
Важно отметить, что амфотерные металлы переходных элементов могут проявлять различную степень амфотерности в зависимости от условий реакции. Например, алюминий в щелочной среде образует гидроксид, а в кислотной среде - соль.
Группа 2: амфотерные металлы главных групп
Группа 2 периодической системы элементов состоит из металлов, которые обладают амфотерными свойствами. Они способны проявлять как кислотные, так и основные характеристики, то есть реагировать как с кислотами, так и с основаниями. В этой группе находятся металлы, такие как кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Амфотерные металлы главных групп обладают свойством образовывать оксиды, которые могут реагировать как с кислотами, так и с основаниями. Например, кальций образует оксид CaO, который является основным оксидом, реагирующим с кислотами. Однако, в присутствии неполярных растворителей, таких как бензол, оксид кальция может растворяться и образовывать ионы гидроксида, проявляя основные свойства.
Амфотерные металлы главных групп также могут образовывать гидроксиды, которые реагируют с кислотами и основаниями. Например, барий образует гидроксид Ba(OH)2, который является сильным основанием и реагирует с кислотами. Однако, в присутствии сильных оснований, гидроксид бария может проявлять кислотные свойства и реагировать с основаниями.
Амфотерные металлы главных групп являются важными реагентами во многих химических процессах. Их способность проявлять как кислотные, так и основные свойства обуславливает широкий спектр их применений. Например, радий используется в медицине для лечения рака, а стронций применяется в производстве ядерных реакторов. Понимание амфотерных свойств этих металлов позволяет разрабатывать новые способы их использования и создавать многообещающие материалы с уникальными свойствами.
Примеры амфотерных металлов

Существует несколько групп металлов, которые проявляют амфотерные свойства - это способность реагировать как с кислотами, так и с щелочами. Одним из примеров амфотерных металлов является алюминий.
Алюминий (Al) - третий по распространенности элемент в земной коре. Он может реагировать с кислотами, образуя соли, и с щелочами, образуя гидроксиды. Так, при взаимодействии с щелочами алюминий образует алюминаты, а с кислотами - алуминаты. Это свойство амфотерности делает алюминий важным компонентом в различных сферах, включая производство алюминиевых сплавов и конструкций.
Другим примером амфотерного металла является цинк (Zn). Цинк может образовывать соли с кислотами и гидроксиды с щелочами. В реакциях с кислотами образующиеся соли цинка широко используются в различных отраслях промышленности, включая производство красок и покрытий. Реакции цинка с щелочами, например, с гидроксидами, могут использоваться для получения соединений цинка, которые найдут применение в электрохимических устройствах и аккумуляторах.
Один из наиболее известных амфотерных металлов - это свинец (Pb). Он может реагировать с кислотами, образуя соли, и с щелочами, образуя гидроксиды. Свойства амфотерности свинца делают его полезным во многих отраслях, включая производство аккумуляторов и покрытий. Кроме того, свинец используется в процессах легирования различных металлов и в производстве стекла и керамики.
Реакции амфотерных металлов с кислотами и щелочами

Амфотерные металлы – это класс элементов, которые могут образовывать соединения как с кислотами, так и с щелочами. Это свойство обусловлено наличием у них свободных электронных пар и возможностью взаимодействовать с разными видами химических соединений.
С реакцией амфотерных металлов с кислотами образуются соли. В этом случае металл замещает водород в кислоте и образует ион металла с положительным зарядом. Например, реакция алюминия с соляной кислотой приводит к образованию хлорида алюминия и выделению водорода:
Al + HCl → AlCl3 + H2
С другой стороны, амфотерные металлы могут реагировать с щелочами, образуя гидроксиды металлов с отрицательными зарядами. Такие реакции обычно происходят с образованием солей и воды. Например, реакция алюминия с гидроксидом натрия приводит к образованию гидроксида алюминия и выделению натрия:
2Al + 2NaOH → 2NaAlO2 + H2
Реакции амфотерных металлов с кислотами и щелочами являются важными в химической индустрии, так как позволяют получать различные ценные соединения и материалы. Они также играют важную роль в биохимии, так как амфотерные металлы являются основными компонентами многих ферментов и белковых структур.
Вопрос-ответ

Что такое амфотерные металлы?
Амфотерными металлами называются металлы, которые могут образовывать как ионы с положительным зарядом, так и с отрицательным зарядом в химических реакциях. Они обладают свойствами и кислот, и оснований.
Какие группы включает в себя амфотерные металлы?
Амфотерные металлы включают в себя группу алюминия, группу цинка и группу свинца.
Какие химические свойства имеют амфотерные металлы?
Амфотерные металлы могут реагировать с кислотами, образуя соли, и с основаниями, образуя гидроксиды. Также они могут образовывать соединения с отрицательным зарядом, например, с анионами гидроксила или оксидами.
