Амфотерные металлы - это класс материалов, обладающих способностью проявлять свойства как кислот, так и щелочей. Такое поведение возникает благодаря наличию нескольких окислительных состояний, которые позволяют металлам реагировать как с кислотами, так и с щелочами. Это свойство делает амфотерные металлы универсальными веществами, которые могут принимать участие в множестве химических реакций и оказывать влияние на разные системы.
Одним из примеров амфотерных металлов является алюминий (Al). Алюминий имеет валентность +3 и может образовывать как оксиды кислотного характера (например, Al2O3), так и гидроксиды щелочного характера (например, Al(OH)3). В результате, алюминий может реагировать и с кислотами, и с щелочами, образуя соответствующие соли и вещества. Алюминий широко используется в промышленности, а также в производстве различных материалов и изделий.
Другим примером амфотерных металлов является цинк (Zn). Цинк обладает валентностью +2 и может образовывать оксиды как кислотного (ZnO), так и щелочного (Zn(OH)2) характера. Таким образом, цинк может реагировать и с кислотами, и с щелочами, образуя различные соли и вещества. Цинк применяется в различных отраслях промышленности, в том числе в производстве лекарственных препаратов, гальванических покрытий, а также в ряде других технических и научных областей.
Таким образом, амфотерные металлы представляют собой группу материалов, обладающих уникальными свойствами, позволяющими им проявлять кислотные и щелочные свойства. Примерами амфотерных металлов являются алюминий и цинк, которые широко используются в различных отраслях производства и научных исследований.
Амфотерные металлы: свойства и примеры
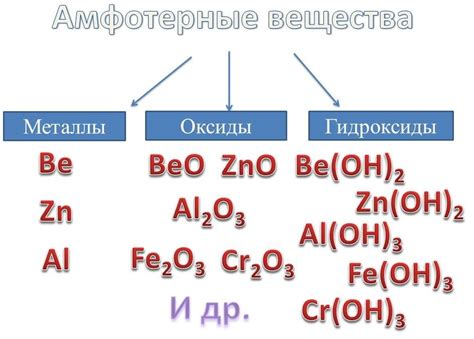
Амфотерные металлы - это класс элементов, которые могут проявлять свойства как металлов, так и неметаллов в зависимости от условий химических реакций. Это довольно редкий класс металлов, и наиболее известные примеры амфотерных металлов включают алюминий, цинк и свинец.
Свойство амфотерности означает, что эти металлы могут реагировать как с кислотами, так и с щелочами. В кислотных реакциях амфотерные металлы выступают в качестве оснований, принимая на себя протоны, а в реакциях с щелочами они проявляют свойства кислот, отдавая свои протоны.
Например, алюминий является одним из наиболее известных амфотерных металлов. Он образует основания в реакциях с кислотами, а также образует соли с щелочами. Это свойство амфотерности делает алюминий важным компонентом в различных промышленных процессах, включая производство алюминия, катализаторов и других химических соединений.
Кроме алюминия, амфотерные свойства проявляют также цинк и свинец. Цинк реагирует как металл с кислотами и как основание с щелочами. Свинец также образует соли с кислотами и реагирует с щелочами.
Важно отметить, что амфотерные металлы демонстрируют свойства амфотерности только в определенных условиях. Их реакционная способность будет зависеть от конкретной кислоты или щелочи, с которой они взаимодействуют, а также от других химических факторов.
Свойства амфотерных металлов
Амфотерные металлы - это группа веществ, которые могут проявлять свойства как кислот, так и оснований в химических реакциях. Они обладают способностью реагировать с кислотами для образования солей и с основаниями для образования гидроксидов.
Одно из основных свойств амфотерных металлов - это их способность образовывать ионы с переменной степенью окисления. Это означает, что они могут принимать различное количество электронов в химических реакциях и образовывать соответствующие ионы с разными зарядами.
Еще одним характерным свойством амфотерных металлов является их реакция с водой. Они могут образовывать гидроксиды, которые растворяются в воде и образуют ионы гидроксида. Это дает им основное свойство. Однако они также могут реагировать с водными растворами кислот и образовывать соли. Таким образом, амфотерные металлы проявляют и кислотные, и основные свойства при контакте с водой.
Некоторые примеры амфотерных металлов включают алюминий (Al), цинк (Zn), свинец (Pb), железо (Fe), медь (Cu) и многие другие. Эти металлы широко используются в различных промышленных процессах, таких как производство металлических сплавов, покрытий и электроники. Их амфотерные свойства позволяют им взаимодействовать с различными химическими веществами и использоваться в различных приложениях.
Примеры амфотерных металлов

Амфотерными металлами называются такие металлы, которые обладают способностью взаимодействовать как с кислотами, так и с щелочами. Вот некоторые примеры амфотерных металлов:
- Алюминий (Al): Алюминий - один из самых распространенных амфотерных металлов. Он может реагировать как с кислотами, так и с щелочами. Например, алюминий реагирует с соляной кислотой, образуя хлорид алюминия, и реагирует с гидроксидом натрия, образуя гидроксид алюминия.
- Цинк (Zn): Цинк также является амфотерным металлом. Он может реагировать как с кислотами, так и с щелочами. Например, цинк реагирует с серной кислотой, образуя сульфат цинка, и реагирует с гидроксидом калия, образуя гидроксид цинка.
- Свинец (Pb): Свинец также проявляет амфотерные свойства. Он способен реагировать как с кислотами, так и с щелочами. Например, свинец реагирует с соляной кислотой, образуя хлорид свинца, и реагирует с гидроксидом аммония, образуя гидроксид свинца.
Это лишь несколько примеров амфотерных металлов. Многие другие металлы также обладают амфотерными свойствами, что делает их универсальными веществами, способными взаимодействовать с различными типами соединений.
Реакции амфотерных металлов с кислотами

Амфотерные металлы - это металлы, которые могут проявлять как кислотные, так и основные свойства. Они способны реагировать как с кислотами, так и с щелочами, в зависимости от условий реакции. Одной из важных реакций амфотерных металлов является их взаимодействие с кислотами.
Когда амфотерный металл вступает в реакцию с кислотой, происходит передача протона от кислоты к металлу. Таким образом, металл выступает в роли основания и образует соль с кислотой. Например, алюминий может реагировать с соляной кислотой, образуя соль алюминия - алюминиевый хлорид, и выделяя молекулу воды.
Реакция амфотерного металла с кислотой может также протекать в обратном направлении, когда металл выступает в роли кислоты и передает протон кислоте. Например, железо может реагировать с серной кислотой, образуя соль железа и выделяя молекулу воды.
Реакции амфотерных металлов с кислотами важны в различных химических процессах, таких как производство солей, очистка загрязненных вод и др. Эти реакции отражают особую способность амфотерных металлов взаимодействовать с различными типами реагентов и варьировать свои химические свойства в зависимости от окружающей среды.
Реакции амфотерных металлов с основаниями

Амфотерные металлы – это металлы, которые могут проявлять кислотные и основные свойства в реакциях с различными соединениями. Рассмотрим реакции амфотерных металлов с основаниями.
Первым примером амфотерного металла является алюминий. Алюминий реагирует с концентрированным раствором натриевой гидроксида (NaOH), образуя соли алюминия и выделяя гидроген. Реакция происходит с выделением большого количества тепла и образованием раствора с щелочными свойствами.
Вторым примером амфотерного металла является цинк. Цинк также реагирует с раствором натриевой гидроксида, образуя соли цинка и гидроген. Однако, реакция цинка с основаниями происходит медленнее, чем алюминия.
Третьим примером амфотерного металла является свинец. Свинец тоже реагирует с раствором натриевой гидроксида, образуя соли свинца и выделяя гидроген. Реакция свинца с основаниями происходит медленно и требует высоких температур для инициирования.
Реакции амфотерных металлов с основаниями подтверждают их способность проявлять как основные, так и кислотные свойства в зависимости от условий реакции и соединения, с которым они взаимодействуют.
Применение амфотерных металлов

Амфотерные металлы - это металлы, которые могут образовывать как катионы, так и анионы в химических реакциях. Благодаря своим уникальным свойствам, амфотерные металлы находят широкое применение в различных областях.
Амфотерные металлы используются в процессе производства катализаторов. Например, медь (Cu) и цинк (Zn) используются в катализаторах, которые применяются в процессе гидрогенирования органических соединений. Это позволяет значительно повысить эффективность и скорость химических реакций.
Амфотерные металлы применяются в производстве электроники. Некоторые из них, такие как алюминий (Al) и цирконий (Zr), используются в процессе создания проводов и контактов в различных электронных устройствах. Это связано с их высокой электропроводностью и химической стабильностью.
Амфотерные металлы широко применяются в производстве керамики и стекла. Например, алюминий и цинк используются в процессе создания различных видов керамики, таких как фарфор и керамические плитки. Кроме того, цинк находит применение в производстве стекла, которое получается при смешивании его с другими компонентами.
Амфотерные металлы применяются в сфере медицины и фармацевтики. Они используются в составе различных препаратов, таких как антисептики и противомикробные средства. Например, алюминий содержится во многих препаратах, используемых для лечения кишечных заболеваний и регулирования кислотно-щелочного баланса.
Амфотерные металлы находят применение в производстве аккумуляторов и батарей. Один из основных компонентов аккумуляторов - свинец (Pb), является амфотерным металлом. Он применяется в качестве электрода, способного как принимать, так и отдавать электроны в процессе химических реакций, что позволяет аккумулятору накапливать и выделять электрическую энергию.
Амфотерные металлы находят широкое применение в различных отраслях промышленности и научных исследованиях. Например, алюминий используется в производстве легких и прочных материалов, таких как алюминиевые сплавы. Магний (Mg), являясь амфотерным металлом, используется в процессе создания фотоэлементов и легких сплавов для авиационной и автомобильной промышленности. Эти металлы имеют широкий спектр применения и значительно облегчают конструкции изделий и технических устройств.
Вопрос-ответ

Какие металлы являются амфотерными?
Амфотерными металлами называются металлы, способные реагировать как с кислотами, так и с щелочами. Некоторые примеры амфотерных металлов включают алюминий, цинк, свинец, железо и медь.
Какие свойства обуславливают амфотерность металлов?
Свойства, обуславливающие амфотерность металлов, включают их способность образовывать ионы с различной степенью окисления. Кроме того, амфотерные металлы обладают реакционной способностью с кислотами и щелочами, что позволяет им проявлять амфотерные свойства.
