Амфотерные металлы – это класс элементов, которые могут проявлять свойства как металлов, так и неметаллов. Они могут реагировать как с кислотами, так и с щелочами в зависимости от условий. В этой статье мы рассмотрим реакцию амфотерных металлов с кислотами и разберем, что нужно знать о данном явлении.
Когда амфотерные металлы взаимодействуют с кислотами, они образуют соли и выделяются газы. Обычно в стандартных условиях амфотерные металлы реагируют с кислотами, образуя растворимые соли. Некоторые амфотерные металлы, такие как алюминий и цинк, образуют соли, которые диссоциируются в водном растворе. В результате образуются ионы металла и ионы кислоты.
Важно отметить, что реакция амфотерных металлов с кислотами может происходить только при определенных условиях. Например, некоторые амфотерные металлы могут реагировать только с конкретными кислотами или при определенной концентрации. Также стоит учитывать, что реакционная способность амфотерных металлов может изменяться при изменении pH среды.
Амфотерные металлы и их реакция с кислотами
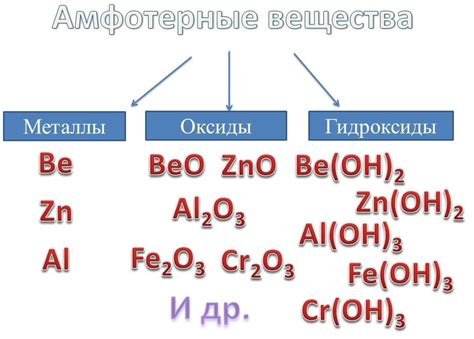
Амфотерные металлы - это металлы, которые могут проявлять свойства как оснований, так и кислот. Это свойство связано с наличием у них свободных электронных пар или возможностью формирования ковалентных или ионных связей.
Реакция амфотерных металлов с кислотами зависит от их электрохимических свойств и силы кислоты. При взаимодействии с кислотой амфотерные металлы могут образовывать различные соединения. Например, алюминий может реагировать с сильными кислотами, образуя соли и выделяя водород газ. Также амфотерные металлы могут образовывать гидроксиды при реакции с разбавленными кислотами.
Реакция амфотерных металлов с кислотами имеет большое практическое значение. Например, амфотерные оксиды и гидроксиды алюминия и железа используются в процессе обезжиривания и нейтрализации в промышленности. Также реакция амфотерных металлов с кислотами может быть использована для определения их присутствия или изоляции из смесей.
Важно отметить, что реакция амфотерных металлов с кислотами происходит под влиянием pH среды. При нейтральном pH такие металлы могут образовывать гидроксиды, при низком pH - соли, а при высоком pH - металлоксиды. Такая реакция может быть регулируемой и использоваться для различных целей в химической промышленности и лаборатории.
Особенности реакции амфотерных металлов

1. Амфотерные металлы - это элементы, которые могут проявлять свойства как металлов, так и неметаллов. Такие металлы обладают способностью реагировать как с кислотами, так и с щелочами.
2. Реакция с кислотами. Амфотерные металлы могут проявлять кислотные свойства при взаимодействии с сильными основаниями. В результате реакции образуются соли и освобождаются водородные ионы.
3. Реакция с основаниями. Амфотерные металлы также могут проявлять основные свойства при взаимодействии с кислотами. В этом случае образуются соли и продукты реакции с водой.
4. Примеры амфотерных металлов:
- Алюминий (Al) - реагирует с кислотами, например, с HCl, образуя соль AlCl3 и высвобождая водород.
- Цинк (Zn) - образует соль ZnCl2 и освобождает водород при реакции с HCl.
- Свинец (Pb) - реагирует с соляной кислотой (HCl) и образует соль PbCl2 и высвобождает водород.
5. Реакционные условия. Реакция амфотерных металлов с кислотами зависит от реакционных условий, таких как концентрация кислоты, температура и наличие катализаторов.
Важное понятие - амфотерность металлов

Амфотерность металлов - это свойство некоторых химических элементов проявляться как основания, так и кислоты в различных химических реакциях. Такое поведение возможно благодаря особой электронной структуре атомов данных металлов.
Ключевую роль в амфотерности металлов играет наличие у них свободных электронов в валентной оболочке, которые способны образовывать химические связи как с кислотами, так и с основаниями. Такие металлы обладают высокой активностью и способны изменять свой окислительно-восстановительный потенциал.
Проявление амфотерности металлов может иметь существенное значение при реакциях с кислотами. В таких реакциях амфотерные металлы могут либо претерпевать окислительную реакцию и образовывать соли, либо претерпевать восстановительную реакцию и образовывать гидроксиды.
Амфотерные металлы встречаются в различных областях химии и находят применение в различных технологических процессах и промышленных производствах. Примерами амфотерных металлов являются алюминий, свинец, цинк, железо и многие другие. Изучение свойства амфотерности металлов позволяет понять их реакционную способность и использовать их в различных химических процессах.
Примеры реакции амфотерных металлов с кислотами

Амфотерные металлы — это металлы, которые могут реагировать как с кислотами (образуя соли), так и с основаниями (образуя гидроксиды). В результате таких реакций образуются соли амфотерных металлов.
Примером такой реакции является реакция алюминия (Al) с соляной кислотой (HCl). При этом образуется соль (алюминий хлорид) и выделяется водород:
- 2Al + 6HCl → 2AlCl3 + 3H2
Ещё одним примером является реакция цинка (Zn) с серной кислотой (H2SO4). В результате образуется соль (цинк сульфат) и выделяется сероводород:
- Zn + H2SO4 → ZnSO4 + H2S
Реакция магния (Mg) с уксусной кислотой (CH3COOH) приводит к образованию соли (ацетат магния) и выделению углекислого газа:
- Mg + 2CH3COOH → (CH3COO)2Mg + H2
Важно отметить, что эти примеры являются лишь некоторыми из множества возможных реакций амфотерных металлов с кислотами. Химия амфотерных металлов представляет большой интерес для научных исследований и находит применение в различных областях, включая медицину, промышленность и технологии.
Вопрос-ответ

Что такое амфотерные металлы?
Амфотерными металлами называются элементы, которые могут проявлять свойства как металлов, так и неметаллов. Они способны реагировать с кислотами, образуя соли, а также с основаниями, образуя гидроксиды.
Какие металлы являются амфотерными?
К амфотерным металлам относятся, например, алюминий, железо и цинк. Эти металлы могут реагировать как с кислотами, так и с основаниями.
Как происходит реакция амфотерных металлов с кислотами?
При реакции амфотерных металлов с кислотами возможны два сценария. Если кислота сильная, то металл образует соль и выделяется водород. Если кислота слабая, то металл растворяется в кислоте и образует ион металла с образованием воды.
