Амфотерные металлы - это металлы, которые могут проявлять свойства как оснований, так и кислот. Вопрос о взаимодействии амфотерных металлов с водородом интересует многих исследователей, так как это позволяет получить новые соединения с уникальными свойствами.
Взаимодействие амфотерных металлов с водородом может протекать по нескольким путям. Одним из основных способов является диспропорционирование водорода, когда металл одновременно выступает в качестве окислителя и восстановителя. Например, амфотерный металл алюминий может реагировать с водородом при образовании гидроксида алюминия и воды.
Взаимодействие амфотерных металлов с водородом также может протекать через образование комплексных соединений. Некоторые амфотерные металлы, такие как железо и цинк, могут образовывать комплексы с водородом, в которых водород выступает в качестве лиганда. Такие соединения могут иметь важные прикладные свойства, например, использоваться в качестве катализаторов в различных химических реакциях.
Особенности взаимодействия амфотерных металлов с водородом определяются не только химическими свойствами металлов, но и условиями реакции. Температура, давление, наличие катализаторов и других веществ могут существенно влиять на характер реакции и образование конечных продуктов.
Что такое амфотерные металлы?
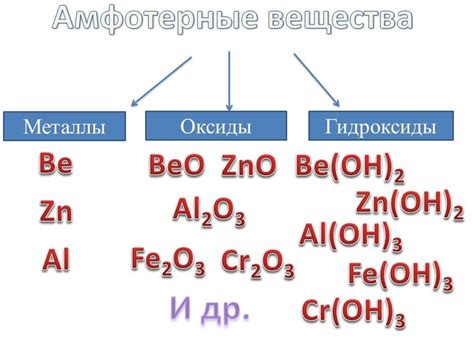
Амфотерными металлами называются химические элементы, которые могут проявлять и кислотные, и основные свойства в химических реакциях. Такие металлы могут взаимодействовать как с кислотами, так и с основаниями, образуя с ними соли и водород.
Важной особенностью амфотерных металлов является существование двух степеней окисления, что позволяет им образовывать различные соединения с разными веществами. Некоторые амфотерные металлы встречаются в природе в виде минералов, а некоторые - в составе различных соединений.
Примерами амфотерных металлов являются алюминий, железо и цинк. Алюминий может реагировать с кислотами, например, соляной, образуя соль - алюминий хлорид. Также амфотерные металлы способны образовывать гидроксиды, например, железо и цинк могут вступать в реакцию с щелочью, образуя соответствующие гидроксиды.
Важным примером взаимодействия амфотерных металлов является их реакция с водородом. В результате этого взаимодействия образуются соли в форме гидридов металлов, которые могут иметь различные свойства. Это открывает широкие возможности использования амфотерных металлов в различных областях, включая промышленные и научные цели.
Особенности амфотерных металлов и их взаимодействие с водородом

Амфотерные металлы - это элементы, которые могут проявлять свойства и кислот, и щелочей в зависимости от условий реакции. В периодической таблице амфотерные металлы находятся в блоке d и p, такие как алюминий, цинк, олово и свинец.
Взаимодействие амфотерных металлов с водородом происходит в результате образования соответствующих гидридов. Амфотерные металлы способны реагировать как с кислыми, так и с щелочными оксидами, и данное свойство также проявляется в их взаимодействии с водородом.
При реакции амфотерного металла с водородом образуются гидриды, которые можно классифицировать как металлические гидриды или солевые гидриды. Металлические гидриды обычно образуются с амфотерными металлами, что связано с их способностью принимать на себя электроны и образовывать отрицательные ионы. Солевые гидриды, наоборот, образуются с щелочными металлами и представляют собой ионы гидрида в сочетании с ионами металла.
Взаимодействие амфотерных металлов с водородом может протекать с образованием металлогидридов или водородных ионов. Одной из характерных реакций является образование амфотерных оксидов металла и воды в результате взаимодействия металла с водородом в присутствии кислорода. Данные реакции играют важную роль в промышленности, так как амфотерные металлы широко используются в производстве различных материалов и соединений.
Результаты реакции амфотерных металлов с водородом

Реакция амфотерных металлов с водородом является сложной и может проявляться в различных вариантах, в зависимости от условий и химического состава реагирующих веществ. Результаты таких реакций могут быть как положительными, так и отрицательными.
В некоторых случаях, амфотерные металлы могут проявлять активность по отношению к водороду, что приводит к образованию гидридов. Эти вещества являются стабильными и могут быть использованы в различных отраслях промышленности. Например, гидриды амфотерных металлов могут использоваться в качестве катализаторов, водородных поглотителей или веществ для хранения водорода.
Однако, в большинстве случаев, амфотерные металлы не реагируют с водородом или проявляют слабую активность. Это связано с тем, что водород образует сильные связи с амфотерными металлами, такими как алюминий или цинк, что затрудняет процесс их реакции. В таких случаях, алюминий или цинк не проявляют достаточной активности для образования гидридов.
Таким образом, результаты реакции амфотерных металлов с водородом зависят от множества факторов, включая условия реакции, среду, свойства металла и реагента. В ряде случаев, реакция может привести к образованию стабильных гидридов, которые могут иметь практическое применение. В других случаях, амфотерные металлы не реагируют с водородом или проявляют слабую активность.
Примеры амфотерных металлов и их химические свойства

Амфотерные металлы - это металлы, которые могут вступать и в кислотные, и в основные реакции. Они обладают способностью взаимодействовать с различными кислотами и основаниями, проявляя свои характерные химические свойства.
Один из примеров амфотерных металлов - это алюминий (Al). Алюминий может вступать в реакцию с кислотами, например, с соляной кислотой (HCl), образуя соль и выделяя водород газ: 2Al + 6HCl -> 2AlCl3 + 3H2. Также алюминий может реагировать с основаниями, образуя алюминиевые гидроксиды, например, с гидроксидом натрия (NaOH): 2Al + 2NaOH + 6H2O -> 2NaAl(OH)4 + 3H2.
Другим примером амфотерного металла является цинк (Zn). Цинк может реагировать с кислотами, например, с серной кислотой (H2SO4), образуя соль и выделяя водород газ: Zn + H2SO4 -> ZnSO4 + H2. Также цинк может вступать в реакцию с основаниями, образуя цинковые гидроксиды, например, с гидроксидом натрия (NaOH): Zn + 2NaOH -> Na2ZnO2 + H2O.
Другие амфотерные металлы включают алюминий (Al), олово (Sn), свинец (Pb), железо (Fe) и другие. Их химические свойства позволяют им проявлять активность как в кислых, так и в щелочных условиях, что открывает широкие возможности для их применения в различных химических процессах и промышленных производствах.
Значение взаимодействия амфотерных металлов с водородом в промышленности и науке

Взаимодействие амфотерных металлов с водородом имеет важное значение как в промышленности, так и в науке. Эти металлы, такие как алюминий, цинк, свинец и другие, могут проявлять как кислотные, так и щелочные свойства, что позволяет им реагировать с различными соединениями водорода.
В промышленности взаимодействие амфотерных металлов с водородом широко применяется при производстве водорода, аммиака и других химических соединений. Например, алюминий может быть использован в процессе алюминотермического восстановления для получения водорода. Это эффективный и экономичный метод получения водорода, который широко используется в промышленности.
В науке взаимодействие амфотерных металлов с водородом изучается для понимания механизмов реакций и развития новых методов синтеза. Исследования показывают, что амфотерные металлы могут образовывать различные соединения с водородом, включая гидриды, оксогидриды и другие. Это позволяет создавать новые материалы с улучшенными свойствами, такие как высокая электропроводность или каталитическая активность.
Таким образом, взаимодействие амфотерных металлов с водородом играет важную роль в промышленности и науке, обеспечивая производство химических соединений и развитие новых материалов. Дальнейшие исследования в этой области могут привести к разработке ещё более эффективных методов синтеза и получению материалов с улучшенными свойствами для различных применений.
Вопрос-ответ

Какие вещества являются амфотерными металлами?
Амфотерными металлами являются те, которые могут образовывать как катионы, так и анионы в реакциях с водородом. К таким металлам относятся алюминий, цинк, германий, индий и др.
Как происходит взаимодействие амфотерных металлов с водородом?
Взаимодействие амфотерных металлов с водородом может происходить по двум основным реакциям: образование металлического гидрида и реакция с образованием катионов металла и ионов водорода. В первом случае металл принимает на себя электроны, а во втором - отдает их.
Какие реакции возможны при взаимодействии амфотерных металлов с водородом?
При взаимодействии амфотерных металлов с водородом возможны различные реакции, включая образование гидридов, реакцию с образованием металлических соединений и взаимодействие металла с образованием оксидов или солей. Например, алюминий взаимодействует с водородом, образуя алюминиевый гидрид, а цинк может образовывать цинкальные гидриды.
