Амфотерные металлы - это класс элементов, которые могут проявлять свойства как кислот, так и оснований, то есть они могут реагировать как с кислотными, так и с основными реактивами. Эти металлы обладают особым строением своей электронной оболочки, что позволяет им проявлять амфотерные свойства.
Примером амфотерных металлов является алюминий. Встречается он в природе в виде бокситов, а также производится искусственным путем. Алюминий реагирует как с кислотами, так и с основаниями. Например, сильные кислоты, такие как серная и хлороводородная, вызывают образование солей алюминия. Сильные щелочи, например, натрий гидроксид, также вызывают образование солей алюминия.
Другим примером амфотерного металла является цинк. Цинк может реагировать как с кислотами, так и с основаниями. Например, сильная кислота, такая как соляная кислота, вызывает реакцию с цинком и образование соли цинка. При этом цинк выступает в роли окислителя, приобретая положительный заряд. Сильное основание, например, гидроксид натрия, вызывает реакцию с цинком и образование гидроксида цинка. В данном случае цинк выступает в роли редуктора, приобретая отрицательный заряд.
Что такое амфотерные металлы

Амфотерные металлы - это класс химических элементов, обладающих способностью проявлять как кислотные, так и основные свойства при реакции с другими веществами. Это особенное свойство делает амфотерные металлы уникальными и важными в химических процессах и промышленности.
Амфотерные металлы способны проявлять кислотные свойства, когда взаимодействуют с основаниями, и основные свойства, когда взаимодействуют с кислотами. Это происходит благодаря наличию свободных электронов в валентной оболочке металла, которые могут образовывать новые химические связи с другими веществами.
Примеры амфотерных металлов включают алюминий (Al), цинк (Zn), свинец (Pb) и железо (Fe). Эти металлы могут реагировать с различными кислотами и основаниями, образуя разнообразные химические соединения.
Реакции амфотерных металлов часто происходят в водных растворах, где они могут образовывать гидроксиды или соли при взаимодействии с кислотами и основаниями. Например, алюминий может образовывать алюминиевый гидроксид (Al(OH)3) в реакции с щелочами или алюминиевый сульфат (Al2(SO4)3) в реакции с кислотами.
Изучение амфотерных металлов и их реакций является важной частью химии и позволяет понять основные принципы и законы химических реакций. Эти металлы находят применение в различных отраслях промышленности, включая производство лекарств, пищевых добавок, сплавов и других продуктов.
Примеры амфотерных металлов:

Амфотерные металлы - это металлы, которые могут реагировать как с кислотами, так и с щелочами. Они обладают способностью образовывать соли и гидроксиды при взаимодействии с кислотами и щелочами.
Алюминий (Al) - основной представитель амфотерных металлов. Он реагирует со щелочами, образуя алюминаты, например алюминат натрия: 2Al + 6NaOH -> 2Na3AlO3 + 3H2. С другой стороны, алюминий реагирует с кислотами, образуя соли, например алюминий хлорид: Al + 3HCl -> AlCl3 + 3/2H2.
Цинк (Zn) также является амфотерным металлом. Он реагирует с щелочами, образуя цинкаты, например цинкат натрия: Zn + 2NaOH + 2H2O -> Na2[Zn(OH)4] + H2. Цинк также реагирует с кислотами, образуя соли, например сульфат цинка: Zn + H2SO4 -> ZnSO4 + H2.
Свинец (Pb) - еще один пример амфотерного металла. Он реагирует со щелочами, образуя плумбаты, например плумбат калия: Pb + 4KOH -> K2Pb(OH)4 + 2H2O. Реакция свинца с кислотами приводит к образованию солей, например нитрат свинца: Pb + 4HNO3 -> Pb(NO3)2 + 2H2O + NO2.
Железо (Fe) также обладает амфотерными свойствами. Оно реагирует со щелочами, образуя феррата, например феррат калия: Fe + 6KOH -> K4[Fe(OH)6] + 3H2O. Реакция железа с кислотами приводит к образованию солей, например сульфат железа: Fe + H2SO4 -> FeSO4 + H2.
Таким образом, амфотерные металлы обладают способностью реагировать как с кислотами, так и с щелочами, что позволяет им образовывать различные соли и гидроксиды. Примеры таких металлов включают алюминий, цинк, свинец и железо.
Реакции амфотерных металлов с кислотами

Амфотерные металлы - это металлы, которые способны реагировать и с кислотами, и с основаниями. Реакции амфотерных металлов с кислотами являются одной из важных особенностей их химического поведения.
Когда амфотерные металлы вступают в реакцию с кислотами, образуется соответствующая соль и выделяется водород. Например, алюминий, являющийся одним из наиболее известных амфотерных металлов, реагирует с кислородными кислотами, такими как соляная кислота и серная кислота. В результате образуется соответствующая алюминиевая соль, например, хлорид алюминия или сульфат алюминия, и выделяется водородный газ.
Кроме того, амфотерные металлы также могут реагировать с безводными кислотами, например, хлороводородом. В этом случае образуется соль металла и выделяется водород, аналогично реакции с кислородными кислотами.
Реакции амфотерных металлов с кислотами являются важными не только с точки зрения химической реактивности, но и в практическом применении. Например, алюминий, благодаря своим амфотерным свойствам, используется в производстве различных кислотоустойчивых материалов, таких как алюминиевые окна и крыши, а также в производстве антикоррозионных покрытий.
Реакции амфотерных металлов с щелочами
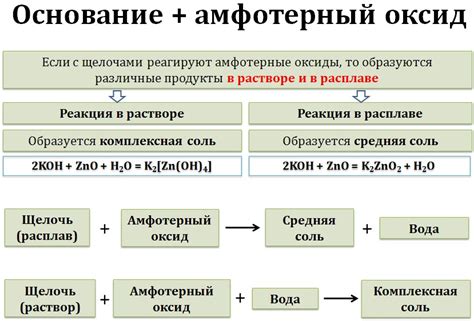
Амфотерные металлы - это вещества, которые имеют способность реагировать как с кислотами, так и с щелочами. К числу амфотерных металлов относятся, например, алюминий (Al), цинк (Zn), олово (Sn), свинец (Pb) и другие.
Реакция амфотерных металлов с щелочами происходит в присутствии воды. В результате этой реакции образуется гидроксид металла и соответствующая соль. Например, алюминий взаимодействует с гидроксидом натрия (NaOH) по следующему уравнению:
2Al + 6NaOH + 3H2O → 2Na3Al(OH)6 + 3H2
В результате этой реакции образуется натриевый гидроксид [Na+ + OH-] и алюминат иона [Al(OH)63-].
Схожие реакции происходят и с другими амфотерными металлами. Например, цинк взаимодействует с гидроксидом натрия (NaOH) по следующему уравнению:
Zn + 2NaOH + 2H2O → Na2Zn(OH)4 + H2
В результате этой реакции образуется натриевый гидроксид [Na+ + OH-] и гидроксид цинка [Zn(OH)42-].
Таким образом, реакции амфотерных металлов с щелочами являются важной характеристикой данных веществ. Они происходят в присутствии воды и приводят к образованию гидроксидов металлов и соответствующих солей.
Реакции амфотерных металлов с оксидами
Амфотерные металлы обладают способностью реагировать как с кислотами, так и с щелочами. Их реакции с оксидами, тоже имеют амфотерный характер. Они проявляют свои кислотные свойства в присутствии щелочи и легко окисляются в растворах сильных кислот.
Например, амфотерный металл алюминий образует реакцию с основаниями. Восстановленный алюминий дает ионный комплекс. С оксидами алюминий образует ионы и амфотерные кислоты. Растворимый оксид алюминия при взаимодействии с щелочью превращается в соль. Образованный осадок имеет щелочные свойства.
Другой пример амфотерного металла - цинк. Восстановленный цинк при реакции с щелочью образует ионный комплекс. Цинкокислота является амфотерной кислотой. Реакция с оксидами цинка приводит к образованию амфотерных кислот и ионов цинка.
Ртуть также является амфотерным металлом, и реакции с оксидами у нее аналогичны алюминию и цинку. Растворимый оксид ртути соединяется с щелочью, образуя несольные прочные сплавы. Они обладают свойствами оснований.
В целом, реакции амфотерных металлов с оксидами позволяют им проявлять свои амфотерные свойства и образовывать ионы, амфотерные кислоты и соли при взаимодействии с щелочью или сильными кислотами.
Важность амфотерных металлов в промышленности

Амфотерные металлы - это такие химические элементы, которые могут проявлять свойства и кислот и щелочей в зависимости от условий реакции. Их уникальные свойства делают амфотерные металлы важными в различных промышленных процессах.
Первым и, пожалуй, самым известным амфотерным металлом является алюминий. Он обладает свойствами и кислот, и щелочей, что делает его востребованным в различных отраслях промышленности. Алюминий активно используется в производстве авиационных и автомобильных деталей, строительных конструкций, упаковочных материалов и электротехнических изделий.
Еще один пример амфотерного металла - свинец. Он широко используется в производстве аккумуляторов и коррозионностойких материалов. Свинец также применяется в радиоэлектронной и химической промышленности. Амфотерные свойства свинца позволяют использовать его для нейтрализации кислых и щелочных растворов.
Другим примером амфотерного металла является цинк. Он находит свое применение в производстве оцинкованной стали, а также в электрогальванике, где цинковое покрытие применяется для защиты от коррозии. Кроме того, цинк используется в производстве лекарственных препаратов и витаминов, а также в сельском хозяйстве для удобрений.
Амфотерные металлы играют важную роль в промышленности, обеспечивая необходимые свойства и функциональность в различных областях производства. Их способность проявлять свойства и кислот, и щелочей позволяет использовать их в широком спектре процессов, от производства материалов до производства лекарственных препаратов и удобрений.
Вопрос-ответ

Какие металлы относятся к амфотерным?
К амфотерным металлам относятся алюминий, цинк, свинец, железо, кобальт, никель и другие.
Какие реакции характерны для амфотерных металлов?
Амфотерные металлы могут проявлять как кислотные, так и основные свойства. Они способны взаимодействовать и с кислотами, и с щелочами.
