Кислород – один из самых известных и широко распространенных химических элементов в мире. Он является важным составным элементом множества соединений и влияет на происходящие химические реакции. В то же время, амфотерные металлы – такие как алюминий, свинец, цинк и многие другие – обладают способностью взаимодействовать как с кислотами, так и с основаниями. Однако, несмотря на это, реакции между кислородом и амфотерными металлами не происходят.
Прежде всего, стоит отметить, что кислород является очень реакционной и электроотрицательной химической субстанцией. Он часто взаимодействует с другими элементами, образуя оксиды. В то же время, амфотерные металлы обычно вступают в реакцию с неметаллическими кислотами, основаниями и амфотерными оксидами. Однако, несмотря на свою активность, кислород не образует реакции с амфотерными металлами.
Одной из основных причин отсутствия реакции между кислородом и амфотерными металлами является их структурная и электронная конфигурация. Амфотерные металлы обычно имеют электронную оболочку, состоящую из d- и s-орбиталей, что делает их способными взаимодействовать как с кислотами, так и с основаниями. Кислород, в свою очередь, обладает электронной конфигурацией, представленной двумя электронами в s-орбитали. Это ограничивает его возможность взаимодействия с амфотерными металлами.
Влияние амфотерных металлов на реакцию с кислородом
Амфотерные металлы - это металлы, которые могут проявлять свойства и характеристики как кислот, так и оснований. Их способность к реакции с различными веществами, включая кислород, определяется их электрохимическими свойствами и структурой атома.
Когда амфотерные металлы вступают во взаимодействие с кислородом, они могут проявить разные типы реакций. В некоторых случаях, они могут образовывать оксиды металлов, которые выступают в качестве оснований или кислот в зависимости от условий.
Однако, известно, что определенные амфотерные металлы, такие как алюминий и цинк, образуют оксиды, которые обладают пассивными свойствами. Это означает, что они не реагируют с кислородом воздуха при нормальных условиях. В таких случаях, металлы образуют защитную пленку оксида на своей поверхности, которая предотвращает дальнейшую реакцию.
Таким образом, влияние амфотерных металлов на реакцию с кислородом зависит от их способности образовывать оксиды, а также от условий, в которых происходит взаимодействие. Данное влияние может быть как активным, когда металл реагирует с кислородом и образует соединения, так и пассивным, когда металл образует защитную пленку, которая препятствует реакции.
Рассмотрим особенности реакции

Кислород является одним из самых активных элементов, способным реагировать с большинством веществ. Однако, существуют амфотерные металлы, которые обладают способностью взаимодействовать как с кислородом, так и с кислотами. Интересно, что, несмотря на свою реактивность, кислород не образует химическую связь с этими металлами.
При соприкосновении с кислородом, амфотерные металлы проявляют свою основную характеристику - получение положительного оксидационного состояния. Это связано с тем, что оксиды амфотерных металлов могут как донорно, так и акцепторно взаимодействовать с другими соединениями. Но, несмотря на это, нет никаких видимых изменений и реакций между кислородом и амфотерными металлами.
Одним из основных факторов, объясняющих отсутствие реакции между кислородом и амфотерными металлами, является их электрохимический потенциал. Кислород обладает высоким электроотрицательным потенциалом, что делает его активным окислителем. В то же время, амфотерные металлы, такие как алюминий, цинк, свинец, обладают низкими значениями электроотрицательности и имеют свойство образовывать пассивные оксиды на своей поверхности.
Несмотря на то, что реакция между кислородом и амфотерными металлами не происходит в обычных условиях, они все же могут взаимодействовать при определенных условиях. Например, при высоких температурах или в присутствии катализаторов. В таких условиях амфотерные металлы могут реагировать с кислородом, образуя оксиды и другие соединения.
Какие металлы являются амфотерными?

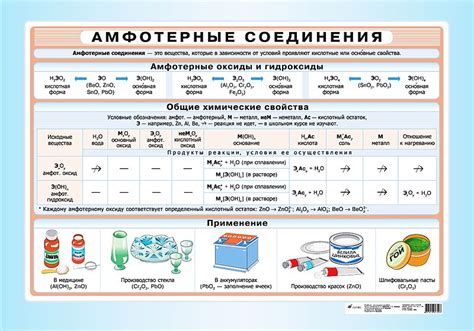
Амфотерные металлы – это группа металлов, которые могут реагировать как с кислотами, так и с основаниями. Это особенное свойство позволяет им проявлять амфотерность и взаимодействовать с различными веществами в зависимости от условий окружающей среды.
Среди различных металлов, некоторые из них проявляют амфотерные свойства. К таким металлам относятся алюминий (Al), цинк (Zn), свинец (Pb) и сурьма (Sb). Эти металлы имеют способность реагировать как с кислотами, так и с основаниями, проявляя различные химические свойства.
Например, алюминий может реагировать с кислотами, образуя соли, такие как алюминиевые сульфаты и алюминиевые хлориды. Однако, алюминий также может реагировать с основаниями, образуя гидроксид алюминия (Al(OH)3), который является сильным основанием.
Цинк может проявить амфотерные свойства при реакции с кислотами, образуя соли, а также может реагировать с основаниями, образуя гидроксид цинка (Zn(OH)2) или окислы, такие как цинковые окиси (ZnO).
Сурьма и свинец также могут проявлять амфотерные свойства и образовывать различные соединения как с кислотами, так и с основаниями.
Таким образом, металлы, обладающие амфотерностью, представляют интерес для химических исследований и применяются в различных областях, включая производство и металлургию.
Почему амфотерные металлы не реагируют с кислородом?
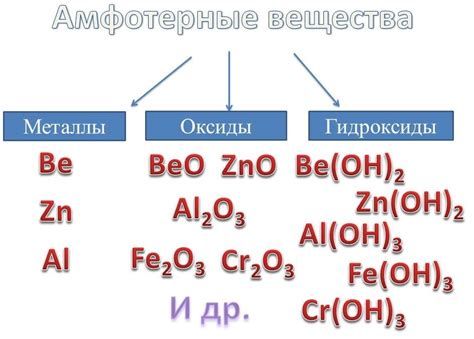
Амфотерные металлы - это группа химических элементов, которые могут реагировать как с кислотами, так и с основаниями. Они обладают способностью проявлять и кислотные, и основные свойства в различных реакциях. Однако, амфотерные металлы, такие как алюминий, цинк, свинец и др., не проявляют реакции с кислородом.
Причина отсутствия реакции между амфотерными металлами и кислородом связана с химическими свойствами этих элементов. Кислород является сильным окислителем, способным вступать в реакцию с многими веществами и образовывать оксиды.
Амфотерные металлы обладают свойством образовывать оксиды, которые могут реагировать как с кислотами, так и с основаниями. Однако, амфотерные металлы не проявляют реакцию с кислородом из-за стабильности образовавшихся оксидов на их поверхности.
Когда амфотерный металл взаимодействует с кислородом, на его поверхности образуется оксидный слой, который защищает металл от дальнейшей реакции с кислородом. Этот оксидный слой является устойчивым и предотвращает проникновение кислорода внутрь металла. Поэтому, несмотря на то, что амфотерные металлы могут проявлять и кислотные, и основные свойства в реакциях, они не реагируют с кислородом.
Особенности химической связи у амфотерных металлов
Амфотерные металлы - это элементы, которые способны проявлять как кислотные, так и основные свойства. Их химическая связь отличается рядом особенностей, которые обуславливаются их электронной структурой и расположением в периодической таблице.
Одной из особенностей связи амфотерных металлов является их способность к образованию различных степеней окисления. Амфотерность обусловлена наличием внешних электронных оболочек, которые могут участвовать в обменных реакциях с другими элементами.
Также характерно то, что амфотерные металлы способны образовывать соединения с различными кислородсодержащими группами. Это объясняется их способностью изменять свою окислительную способность в зависимости от условий реакции.
Для амфотерных металлов характерно также образование комплексных соединений. Они могут образовывать стабильные связи с лигандами, что позволяет им проявлять свои координационные способности и участвовать в различных реакциях с кислотами и основаниями.
Какие реакции могут происходить с амфотерными металлами и кислородом?
Амфотерные металлы - это элементы, которые могут проявлять как свойства металлов, так и свойства неметаллов. К ним относятся, например, алюминий, галлий, индий, цинк.
Кислород, находящийся в атмосфере, обладает высокой активностью и способен вселяться во многие химические реакции. Однако между кислородом и амфотерными металлами обычно не происходят непосредственные химические реакции. Это связано с тем, что амфотерные металлы обычно образуют оксиды, которые малорастворимы в воде.
Например, алюминий образует оксид Al2O3, который взаимодействует с водой, давая гидроксид щелочного характера Al(OH)3. Но при этом алюминий не реагирует напрямую с кислородом.
Вместо этого, амфотерные металлы могут реагировать с кислородом в более сложных химических системах, например, в присутствии сильных окислителей или в кислородсодержащих соединениях. Но такие реакции происходят специфично и зачастую не свойственны обычным условиям.
Применение амфотерных металлов в различных отраслях

Амфотерные металлы имеют уникальное свойство быть реактивными как с кислотами, так и с основаниями. Их применение широко распространено в различных отраслях и играет важную роль в современных технологиях и производстве.
В электронной промышленности амфотерные металлы используются для производства полупроводниковых материалов. Они обладают высокой электропроводимостью и имеют способность менять свои свойства под воздействием различных внешних факторов. Это позволяет создавать полупроводники с различными электрическими характеристиками и применять их в микроэлектронике и приборостроении.
В химической промышленности амфотерные металлы используются в процессах нейтрализации кислот и щелочей. Они способны реагировать как с кислотными, так и с щелочными реагентами, что позволяет эффективно удалять вредные отходы и очищать сточные воды. Кроме того, амфотерные металлы используются в производстве химических соединений и катализаторов.
В металлургии амфотерные металлы широко применяются в процессах получения и обработки металлов. Они используются как основные компоненты различных сплавов, обеспечивая им необходимые механические и физические свойства. Кроме того, амфотерные металлы играют роль катализаторов при производстве стали и других металлических материалов.
В медицине амфотерные металлы находят применение в качестве лекарственных препаратов и добавок к пище. Они обладают антиоксидантными свойствами и способствуют защите организма от вредных воздействий окружающей среды. Кроме того, амфотерные металлы могут использоваться в радиоактивной терапии для лечения рака.
Таким образом, амфотерные металлы играют важную роль в различных отраслях, применяются в электронике, химической промышленности, металлургии и медицине. Их уникальные свойства позволяют создавать новые материалы, разрабатывать новые технологии и обеспечивать безопасность и качество продукции.
Вопрос-ответ

Почему кислород не взаимодействует с амфотерными металлами?
Отсутствие реакции между кислородом и амфотерными металлами объясняется их особенностями в химической структуре. Амфотерные металлы имеют способность проявлять свойства как металлов, так и неметаллов. Эти металлы, такие как алюминий, цинк и другие, образуют оксиды, которые стабильны и не реагируют с кислородом воздуха. Кроме того, амфотерные металлы образуют защитные пленки на своей поверхности, что также препятствует взаимодействию с кислородом.
Каким образом амфотерные металлы защищают себя от реакции с кислородом?
Амфотерные металлы, такие как алюминий и цинк, формируют на своей поверхности тонкие слои оксидов, которые предотвращают дальнейшее взаимодействие с кислородом. Эти оксидные пленки обладают стабильной структурой и предотвращают окисление металла путем блокирования доступа кислорода к поверхности металла.
Возможно ли как-то активировать реакцию между кислородом и амфотерными металлами?
Возможно активировать реакцию между кислородом и амфотерными металлами путем создания более благоприятных условий для окисления. Например, можно повысить температуру или давление, и тогда процесс реакции будет более вероятным. Если металл находится в чистом виде и не имеет защитного оксидного слоя на поверхности, то при наличии достаточно высокой концентрации кислорода и энергии, реакция может произойти.
Почему реакция между кислородом и цинком не происходит при обычных условиях?
Реакция между кислородом и цинком не происходит при обычных условиях из-за образования на поверхности цинка тонкого оксидного слоя, который предотвращает дальнейшее взаимодействие с кислородом. Кроме того, оксид цинка является стабильным и не реагирует с кислородом воздуха. Для активации реакции требуются более высокие температуры и энергия, чтобы разрушить оксидный слой и позволить кислороду реагировать с металлом.
