Амфотерность - это химическое свойство, которое проявляется только у некоторых веществ, особенно у металлов. Это свойство означает, что данное вещество может проявлять как кислотные, так и основные свойства в зависимости от условий реакции.
В основном амфотерные металлы находятся на левой стороне периодической таблицы элементов, таких как алюминий, цинк, свинец и т. д. Эти металлы могут реагировать как с кислотами, образуя соли, так и с основаниями, образуя гидроксиды.
Например, алюминий обладает амфотерными свойствами и может вступать в реакцию как с кислотами, образуя соли, так и с основаниями, образуя гидроксид алюминия. Также, алюминий может реагировать с водой, выделяя гидроген и образуя гидроксид алюминия.
Амфотерность металлов имеет важное практическое значение в различных промышленных процессах и в химической промышленности в целом. Это свойство позволяет использовать амфотерные металлы в широком спектре приложений, включая производство красителей, стекол, керамики и прочих материалов.
Что такое амфотерность?

Амфотерность - это свойство, характерное только для металлов, проявляющееся в их способности взаимодействовать как с кислотами, так и с щелочами.
Амфотерные металлы обладают способностью образовывать с кислотами соли и с щелочами основания. Это свойство обусловлено особенностями строения и электронной структуры металлической решетки.
Когда амфотерный металл взаимодействует с кислотой, он отдает одну или несколько своих электронов, образуя положительный ион-катион. Затем этот ион-катион образует соль с отрицательным ионом-анионом, образовавшимся из кислоты.
Когда амфотерный металл взаимодействует с щелочью, он принимает одно или несколько электронов, образуя отрицательный ион-анион. Затем этот ион-анион образует основание с положительным ионом-катионом, образовавшимся из щелочи.
Примерами амфотерных металлов являются алюминий, цинк, свинец, железо и другие. Их амфотерные свойства играют важную роль в химических реакциях и различных процессах, таких как нейтрализация кислот или щелочей, растворение веществ и другие.
Определение и свойства

Амфотерность – это способность металлов проявлять свойства кислот и оснований. Она является одной из уникальных характеристик металлов, отличающих их от других элементов. Амфотерность позволяет металлам взаимодействовать как с кислотами (в составе реагента), так и с основаниями.
Самым известным примером металла, проявляющего амфотерные свойства, является алюминий. Он может реагировать как с кислотами, например с соляной кислотой, вытесняя из нее водород и образуя соль, так и с основаниями, например с гидроксидом натрия, образуя соль и выделяя воду.
Амфотерные свойства металлов обусловлены их способностью участвовать в окислительно-восстановительных реакциях. Взаимодействие металлов с кислотами основано на способности металлов отдавать электроны, образуя положительные ионы, а с основаниями – на способности металлов принимать электроны, образуя отрицательные ионы.
Амфотерная реакция может происходить как в водной среде, так и в среде, не содержащей воду. Многие металлы, такие как цинк, свинец и другие, не являются амфотерными и образуют лишь соли с кислотами.
Примеры металлов

1. Железо
Железо (Fe) является одним из самых распространенных металлов на Земле. Оно обладает амфотерными свойствами, что означает его способность реагировать и с кислотами, и с основаниями. Железо используется в различных отраслях промышленности, включая машиностроение, строительство, электронику и многие другие.
2. Алюминий
Алюминий (Al) также является металлом с амфотерными свойствами. Он обладает высокой коррозионной стойкостью и легкостью, что делает его одним из наиболее широко используемых металлов в промышленности. Алюминий применяется в производстве авиационной и автомобильной техники, строительных материалов, упаковки и т.д.
3. Цинк
Цинк (Zn) также является амфотерным металлом. Он имеет низкую температуру плавления и хорошую коррозионную стойкость. Цинк используется в гальваническом покрытии, производстве аккумуляторов, в строительстве, а также в производстве лекарственных препаратов.
4. Свинец
Свинец (Pb) - амфотерный металл, который обладает низкой токсичностью. Свинец применяется в аккумуляторах, кабельной промышленности, свинцовых сплавах. Также свинец используется в рентгеновских экранах из-за своей способности поглощать рентгеновское излучение.
5. Медь
Медь (Cu) обладает амфотерными свойствами и является одним из наиболее важных металлов в промышленности. Медь используется в электротехнике, строительстве, производстве монет, украшений, теплообменников и других областях.
Реакции с кислотами
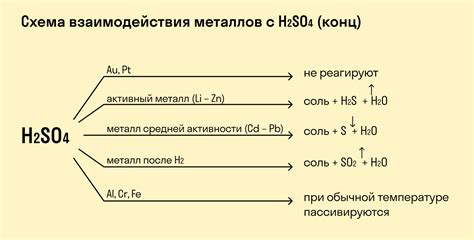
Амфотерность – это свойство металлов, позволяющее им взаимодействовать как с кислотами, так и с щелочами. Реакции металлов с кислотами представляют собой процессы образования солей и выделения водорода.
Взаимодействие металлов с кислотами основано на обмене ионами. Когда металл контактирует с кислотой, происходит распад кислоты на положительные ионы металла и отрицательные ионы кислоты. На этой основе образуется соответствующий соль.
Реактивность металлов в реакциях с кислотами может зависеть от их химической активности и расположения в ряду активности. Например, щелочные металлы (такие как натрий, калий) реагируют с кислотами очень быстро, образуя при этом соответствующие соли и выделяя водородный газ.
Некоторые металлы, такие как алюминий и цинк, могут реагировать только с сильными кислотами, такими как соляная кислота или серная кислота. Результатом таких реакций является образование солей и выделение водорода.
- Пример реакции алюминия с соляной кислотой:
2Al + 6HCl -> 2AlCl3 + 3H2
Важно отметить, что реакции металлов с кислотами могут проходить с выделением водорода, что делает их широко применимыми в различных областях, включая химическую промышленность и энергетику.
Кроме того, реакции металлов с кислотами могут также использоваться для аналитических целей, например, для определения содержания ионов металла в растворе.
Реакции с основаниями
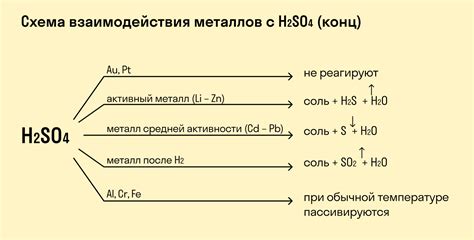
Амфотерные металлы обладают свойством взаимодействовать не только с кислотами, но и с основаниями. Взаимодействие с основанием приводит к образованию солей с ионами металла и ионами гидроксида. Реакция проходит по обратному механизму, чем взаимодействие с кислотами.
Когда амфотерные металлы вступают в реакцию с основаниями, они выступают в качестве окислителей. Ионы металла переходят в более высокую степень окисления и сокращаются, тогда как ионы гидроксида преобразуются в воду. Реакция с основанием может происходить как в водном растворе, так и на поверхности металла.
Примером реакции амфотерного металла с основанием может быть реакция цинка (Zn) с гидроксидом натрия (NaOH). В результате взаимодействия образуется соль цинка(II) гидроксида (Zn(OH)₂), где ионы цинка оказываются в более высокой степени окисления, чем в исходном металле, а ионы гидроксида превращаются в молекулы воды.
Таким образом, амфотерность металлов позволяет им вступать в реакцию с основаниями, что является одним из основных свойств амфотерных металлов. Это свойство находит применение в различных областях, например, в химической промышленности при производстве солей или в медицине при использовании амфотерных металлов в качестве лекарственных препаратов.
Вопрос-ответ

Что такое амфотерность?
Амфотерность - это свойство, характерное только для металлов, которое заключается в их способности проявлять кислотные и щелочные свойства в зависимости от условий.
Какие металлы обладают амфотерностью?
Некоторые примеры металлов, обладающих амфотерностью, включают алюминий, цинк, олово, свинец, железо и некоторые другие.
