Аллотропные модификации щелочных металлов – это различные структурные формы, в которых могут находиться элементы первой группы периодической системы. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают несколькими аллотропными модификациями, которые отличаются внутренней структурой и физическими свойствами. Каждая модификация имеет свою уникальную кристаллическую решетку, что позволяет достичь разнообразия свойств и расширяет область их применения.
Одной из наиболее известных аллотропных модификаций щелочных металлов является кубическая решетка, в которой каждый атом окружен восьмью ближайшими атомами. Эта модификация обладает высокой плотностью, твердостью и плавкостью, что делает ее идеальной для использования в производстве различных металлических изделий и сплавов. Кроме того, такие материалы обладают отличной электропроводностью и часто применяются в электронике и электрической промышленности.
Другой вид аллотропной модификации представляет собой ромбическую решетку, в которой атомы щелочных металлов расположены в форме плоскостей. Такая структура обладает низкой плотностью, хорошей механической гибкостью и отличной деформируемостью. Благодаря этим свойствам, материалы с ромбической решеткой широко применяются в производстве различных материалов с повышенной прочностью и эластичностью, таких как нити, трубы, пленки и другие изделия нужной формы.
Аллотропные модификации щелочных металлов играют важную роль в современной науке и промышленности. Их уникальные свойства и широкая область применения делают их неотъемлемой частью многих технических и технологических процессов. Дальнейшие исследования и разработки в области аллотропных модификаций щелочных металлов позволят расширить и усовершенствовать их применение, что приведет к созданию новых материалов и технологий в различных отраслях науки и промышленности.
Свойства металлических щелочных металлов
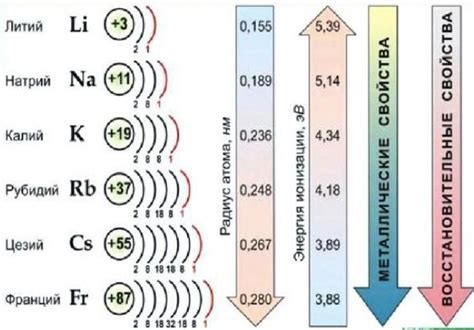
1. Реактивность: Металлические щелочные металлы (литий, натрий, калий, рубидий, цезий и франций) очень реактивны и легко реагируют с кислородом воздуха и водой. Они могут активно гореть и взрываться при контакте с водой, создавая опасность при неправильном обращении.
2. Низкая плотность: Металлические щелочные металлы обладают очень низкой плотностью, что делает их легкими для своего размера. Например, литий имеет плотность всего 0,53 г/см³, тогда как у железа она составляет 7,87 г/см³. Из-за низкой плотности щелочные металлы могут плавать на поверхности воды.
3. Низкая температура плавления и кипения: Щелочные металлы обладают очень низкими температурами плавления и кипения. Например, температура плавления лития составляет всего 180,5 °C, натрия - 97,8 °C, а калия - 63,7 °C. Это делает их полезными для использования в различных промышленных процессах.
4. Электропроводность: Металлические щелочные металлы обладают высокой электропроводностью. Они образуют ионы щелочного металла, которые свободно двигаются в металлической решетке, что обуславливает их способность проводить электрический ток.
5. Образование сплавов: Металлические щелочные металлы могут образовывать сплавы с другими металлами. Например, натрий часто используется в сплавах с алюминием, что повышает прочность и степень коррозионной стойкости сплава.
Металлические щелочные металлы обладают уникальными свойствами, которые делают их полезными для различных промышленных и научных применений. Однако, из-за их высокой реактивности и потенциальной опасности при обращении с ними необходимо соблюдать осторожность и предпринимать соответствующие меры безопасности.
Кристаллические модификации щелочных металлов
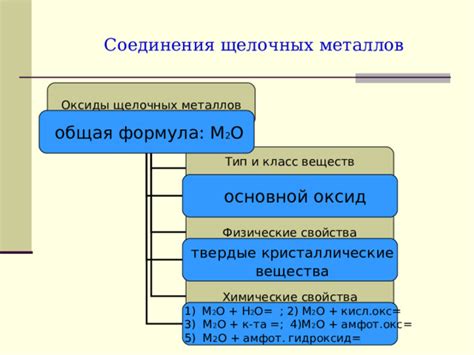
Щелочные металлы, такие как литий, натрий, калий и другие, имеют различные кристаллические модификации, в зависимости от условий их существования. В основном, щелочные металлы образуют кубическую кристаллическую решетку.
Литий, например, образует альфа-модификацию при комнатной температуре. Эта модификация имеет примитивную кубическую решетку и хорошо проводит электрический ток. Однако, при очень низких температурах литий претерпевает фазовый переход в бета-модификацию, которая имеет базально-центрированную кубическую решетку.
У натрия также есть две кристаллические модификации. При комнатной температуре натрий образует кубическую решетку, но при достаточно высоких давлениях он переходит в тетрагональную решетку. Тетрагональная модификация натрия обладает удивительными свойствами, такими как суперпроводимость при очень низких температурах.
Кристаллические модификации щелочных металлов имеют важное значение в различных областях науки и технологий. Они используются в разработке новых материалов, электроники, батарей и других приспособлений. Каждая модификация щелочных металлов обладает своими уникальными свойствами, что открывает новые возможности для исследования и применения в различных сферах человеческой деятельности.
Применение аллотропных модификаций щелочных металлов
Аллотропные модификации щелочных металлов находят широкое применение в различных отраслях научных и промышленных областей. Их уникальные свойства и химическая активность делают их ценными материалами для множества приложений.
Одно из основных применений аллотропных модификаций щелочных металлов – в производстве энергетических устройств. Например, кристаллы ортоксилата лития используются в аккумуляторах и литий-ионных батареях благодаря своим высоким электрохимическим свойствам. Эти материалы обладают высоким удельным зарядом и имеют длительный срок службы, что делает их идеальными для использования в переносных электронных устройствах и электромобилях.
Кроме того, аллотропные модификации щелочных металлов используются в производстве стекол и керамики. Например, калиевый фельдспат является основным компонентом стекла и керамики, благодаря своей способности образовывать кристаллическую структуру и придавать материалу прочность и прочие необходимые свойства. Калий также применяется для придания цвета стеклу и керамике, что позволяет создавать уникальные дизайны и эффекты.
Аллотропные модификации щелочных металлов также используются в химической промышленности. Калий, например, применяется в качестве катализатора во многих химических реакциях. Кроме того, он используется для получения щелочей, гидроксидов и других химических соединений, которые находят применение в водоочистке, производстве мыла, стекловолокна и других продуктах.
В целом, аллотропные модификации щелочных металлов играют важную роль в различных отраслях промышленности и науки. Их свойства и применение продолжают развиваться, открывая новые возможности для создания новых материалов и технологий.
Вопрос-ответ

Какие свойства имеют аллотропные модификации щелочных металлов?
Аллотропные модификации щелочных металлов обладают различными свойствами, такими как цвет, плотность, твердость и т. д. Например, красное вещество, являющееся одной из модификаций калия, обладает ярко-красным цветом, а серая модификация натрия имеет серый цвет и низкую твердость.
Какие применения имеют аллотропные модификации щелочных металлов?
Аллотропные модификации щелочных металлов находят широкое применение в различных областях. Например, красное вещество калия используется в пиротехнике для придания красного цвета огню, а серая модификация натрия применяется в производстве противоударных стекол.
Какова структура аллотропных модификаций щелочных металлов?
Структура аллотропных модификаций щелочных металлов зависит от условий их образования. Например, красное вещество калия имеет структуру кубического гранёного центрирования, а серая модификация натрия образует кубическую сцентрированную решётку.
Каким образом получают аллотропные модификации щелочных металлов?
Аллотропные модификации щелочных металлов получают различными методами. Например, красное вещество калия можно получить путем нагревания металлического калия в аммиачном растворе. Серую модификацию натрия часто получают путем охлаждения расплавленного натрия.
В каких агрегатных состояниях могут находиться аллотропные модификации щелочных металлов?
Аллотропные модификации щелочных металлов могут находиться как в твёрдом, так и в жидком состоянии. Например, красное вещество калия и серая модификация натрия существуют в твёрдом состоянии при комнатной температуре.
