Аквакомплексы металлов представляют собой соединения, в которых металл образует связь с молекулой воды. Эти комплексы имеют особые физические и химические свойства, которые влияют на их поведение в химических реакциях. Одним из основных свойств аквакомплексов является их кислотность.
Молекулы воды, входящие в состав аквакомплексов, могут обладать кислотными свойствами за счет распределения заряда внутри образующихся ионных связей. Как правило, аквакомплексы металлов образуются в растворах, где молекулы воды вступают в реакцию с ионами металла. В результате этой реакции образуются ионы, которые имеют способность передавать протон веществу или принять его от вещества, обладающего основными свойствами.
Аквакомплексы металлов играют важную роль в химическом реакционном равновесии. Они могут участвовать в обратных реакциях, переходя из ионной формы в молекулярную и наоборот. В некоторых случаях аквакомплексы металлов могут присоединяться к другим молекулам вещества, что увеличивает их растворимость или ускоряет химическую реакцию.
Роль аквакомплексов металлов в реакционном равновесии

Аквакомплексы металлов, образующиеся в водных растворах, играют важную роль в химическом реакционном равновесии. Они способны взаимодействовать с другими веществами и участвовать в различных химических превращениях. Аквакомплексы металлов солей обладают свойствами кислот или оснований в зависимости от ионизации металла и тех свойств структуры молекул.
В реакционном равновесии аквакомплексы металлов могут влиять на направление и скорость протекания химической реакции. Они могут изменять активность других соединений, участвующих в реакции, а также управлять потоком электронов в молекулах и ионах.
Аквакомплексы металлов могут стабилизировать реакционный равновесие путем образования комплексов с лигандами, то есть молекулами или ионами, способными образовывать химические связи с металлом. Такие комплексы могут предотвратить обратную реакцию или ускорить процесс образования конечного продукта.
Кроме того, аквакомплексы металлов могут вступать в реакции с другими комплексообразующими соединениями, образуя новые комплексы. Такие реакции могут изменять концентрацию аквакомплексов металлов в растворе и тем самым изменять реакционное равновесие.
В целом, аквакомплексы металлов играют важную роль в химическом реакционном равновесии, влияя на его направление, скорость и стабильность. Изучение свойств аквакомплексов металлов позволяет лучше понять механизмы химических реакций и основы химического равновесия.
Формирование аквакомплексов металлов

Аквакомплексы металлов образуются в результате взаимодействия металлов с молекулами воды. Это происходит за счёт образования координационных связей между металлом и атомами кислорода воды.
Когда металл вступает в реакцию с водой, он принимает на себя электроны, образуя положительно заряженный ион. В это же время, атомы кислорода в воде передают свои электроны металлу, образуя отрицательно заряженные ионы. Такое взаимодействие между металлами и водой позволяет образовываться аквакомплексам.
Образование аквакомплексов металлов играет важную роль в химическом реакционном равновесии. Эти комплексы способны влиять на дальнейшие химические реакции и стабилизировать состояние системы.
Аквакомплексы металлов также обладают кислотными свойствами. Они могут выступать в качестве противотоксических или антиоксидантных соединений, а также участвовать в различных реакциях окисления и восстановления.
Кислотные свойства аквакомплексов металлов
Аквакомплексы металлов представляют собой соединения, в которых металл образует комплекс с водными молекулами. Эти комплексы обладают различными свойствами, включая кислотные.
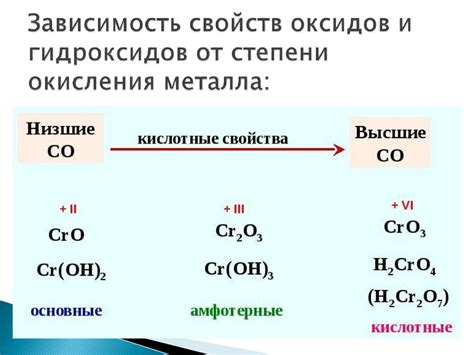
Металлы, формируя аквакомплексы, могут проявлять кислотные свойства за счет ионизации одной из водных молекул. В результате ионизации, образуется оксокислота, содержащая в своей структуре металлический ион и протон. Таким образом, аквакомплексы металлов способны передавать протонный заряд, что является признаком кислотности.
Кислотные свойства аквакомплексов металлов могут проявляться во множестве химических реакций. Например, они могут участвовать в ацидо-базовых реакциях, образуя соли металлов. Также аквакомплексы металлов могут проявлять свою кислотную активность в реакциях с основаниями или с образованием комплексов с другими веществами.
Кислотные свойства аквакомплексов металлов имеют важное значение в химическом реакционном равновесии. Они могут повлиять на направление реакции, и ее скорость. Примером такого влияния может служить формирование аквокомплексов металлов в растворе, что приводит к изменению pH раствора и, следовательно, активности других реагентов и скорости химической реакции.
Реакционное равновесие и аквакомплексы металлов

Реакционное равновесие – это состояние химической системы, при котором скорости протекающих химических реакций равны друг другу, а концентрации реагентов и продуктов остаются постоянными. Важную роль в реакционном равновесии играют аквакомплексы металлов – соединения, где металл связан с молекулами воды.
Аквакомплексы металлов обладают специфическими кислотными свойствами, основанными на возможности передавать протоны или приёмных центров в реакциях. У металлов могут быть различные степени окисления, что влияет на их кислотные свойства и способность образовывать аквакомплексы. Например, комплексы с более низкими степенями окисления образуются сильнее кислотные акваионы, чем комплексы с более высокими степенями окисления.
Реакционное равновесие между акваионами металлов и водой может быть смещено в зависимости от условий реакции. Например, изменение концентрации воды или ионов в растворе может повлиять на распределение акваионов между реакционными компонентами. Это может привести к изменению концентрации металлов в растворе и, следовательно, изменению pH раствора.
Таким образом, аквакомплексы металлов играют важную роль в реакционном равновесии и pH растворов. Их кислотные свойства и способность образования аквакомплексов определяют степень и направление смещения реакционного равновесия. Изучение этих процессов позволяет более глубоко понять химические реакции и особенности образования соединений с участием металлов.
Взаимодействие аквакомплексов с другими веществами
Аквакомплексы металлов проявляют свои химические свойства при взаимодействии с другими веществами. Одним из наиболее распространенных способов взаимодействия является образование комплексных соединений с органическими или неорганическими лигандами.
Аквакомплексы металлов могут реагировать с различными классами соединений, такими как органические кислоты и основания, соли, оксиды и гидроксиды. В результате этих реакций образуются новые соединения с изменением структуры и свойств аквакомплексов.
Например, взаимодействие аквакомплексов с основаниями приводит к образованию аминокомплексов, где водные лиганды замещаются аминогруппами. Это приводит к изменению кислотно-основных свойств аквакомплексов и возможности их использования в различных сферах, таких как катализ, фармацевтика и металлорганическая химия.
Взаимодействие аквакомплексов металлов с органическими кислотами приводит к образованию солей аквокомплексных кислот. Такие реакции имеют проводимость и могут использоваться в качестве протокола для определения металлов в различных образцах.
Таким образом, взаимодействие аквакомплексов металлов с другими веществами играет важную роль в химическом реакционном равновесии, образуя новые соединения с различными свойствами и применениями.
Использование аквакомплексов в химической промышленности

Аквакомплексы металлов являются важными соединениями, которые находят широкое применение в химической промышленности. Они используются для различных процессов, включая катализ реакций, синтез органических соединений и очистку промышленных сточных вод.
Одно из основных преимуществ аквакомплексов металлов в химической промышленности - это их высокая активность и селективность в реакциях. Благодаря комбинированному действию металла и воды в аквакомплексе, образуется особый каталитический центр, способный ускорять химические реакции и обеспечивать желаемые продукты с высокой степенью чистоты.
Аквакомплексы металлов также широко применяются в синтезе органических соединений. Благодаря своей химической активности они могут участвовать в реакциях с различными органическими соединениями, что позволяет получать сложные молекулы с улучшенными свойствами. Это особенно важно в фармацевтической и пищевой промышленности, где требуется высокая чистота и качество синтезированных соединений.
Еще одной областью применения аквакомплексов металлов является очистка промышленных сточных вод. Благодаря своим свойствам, аквакомплексы могут эффективно связывать и выделять загрязняющие вещества из сточных вод, что позволяет снизить их экологическую нагрузку и обеспечить соблюдение стандартов по очистке воды.
В целом, использование аквакомплексов металлов в химической промышленности имеет широкие перспективы и позволяет решать различные задачи, связанные с повышением эффективности процессов, улучшением качества продукции и сокращением негативного влияния на окружающую среду.
Возможные реакции разложения аквакомплексов металлов
Аквакомплексы металлов, образующиеся в результате химических реакций между металлом и водой, могут подвергаться разложению под воздействием различных факторов. Разложение аквакомплексов может протекать по разным механизмам и приводить к образованию новых соединений или освобождению металла в свободную форму.
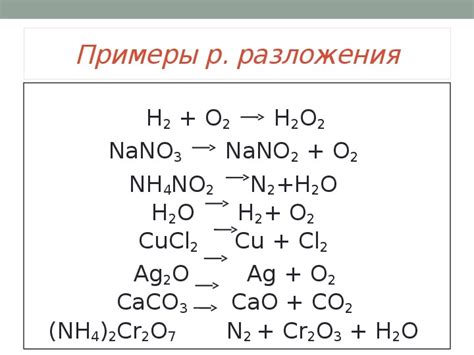
Одним из возможных механизмов разложения аквакомплексов является ионная диссоциация, при которой металлический ион и ион водорода отщепляются от комплексного иона и образуют соответствующие ионы. Например, аквокомплекс меди(II), [Cu(H₂O)₆]²⁺, при воздействии кислоты может разложиться на ион меди(II), Cu²⁺, и ион водорода, H⁺.
Другим возможным механизмом разложения аквакомплексов металлов является замещение координационной воды на другие лиганды. Например, аквокомплекс железа(III), [Fe(H₂O)₆]³⁺, может разложиться при добавлении аммиака, NH₃, или хлорида аммония, NH₄Cl, образуя соответствующие соединения, такие как [Fe(NH₃)₆]³⁺ или [FeCl₆]³⁻.
Кроме того, аквакомплексы металлов могут разлагаться под воздействием высоких температур или электролиза. Например, аквокомплекс никеля(II), [Ni(H₂O)₆]²⁺, при нагревании может разлагаться на никель(II) оксид, NiO, и воду, H₂O, а при электролизе может приводить к выделению свободного никеля.
Вопрос-ответ

Какие металлы могут образовывать аквакомплексы?
Аквакомплексы металлов могут образовываться с различными металлами, такими как железо, медь, никель, цинк и др. Они образуются в результате взаимодействия металлических ионов с молекулами воды.
Какие свойства имеют аквакомплексы металлов?
Аквакомплексы металлов обладают различными свойствами, включая кислотность. Эти комплексы могут проявлять не только кислотные, но и основные свойства, что обуславливается наличием активных центров металла и его способностью взаимодействовать с водой в растворе.
