Активные металлы - это элементы периодической таблицы, которые имеют высокую реактивность и стабильность в водных растворах. При взаимодействии с водой они способны производить различные химические реакции, освобождая водород газ и образуя гидроксид металла.
Один из наиболее известных активных металлов, взаимодействующих с водой при нормальных условиях, - это натрий (Na). При контакте натрия с водой происходит реакция, при которой металл расщепляет молекулу воды на атомы водорода и гидроксид натрия. Реакция проходит с выделением большого количества тепла и образованием белой высушенной капли.
Кроме натрия, с водой также реагируют и другие активные металлы, например, калий (K) и литий (Li). При этом реакция происходит с аналогичным результатом - образуется гидроксид металла и высвобождается водород газ, который может воспламеняться при попадании огня или искры.
Активные металлы, взаимодействующие с водой при нормальных условиях, представляют собой опасность при неправильном обращении. Взаимодействие активных металлов с водой требует особого внимания и тщательных мер предосторожности, так как может привести к возникновению пожара или взрыва.
В заключение, активные металлы, которые взаимодействуют с водой при нормальных условиях, представляют собой интересный объект для изучения в области химии. Реакция данных металлов с водой позволяет получить гидроксиды и использовать выделенный водород в различных технологических исследованиях и процессах.
Водород - активный настоящий металл

Водород - это первый элемент в таблице Менделеева, он обладает свойством активного взаимодействия с водой при нормальных условиях. В результате этого взаимодействия образуется водородный газ, который может быть использован в различных сферах жизнедеятельности человека.
Водород является легким и самым распространенным элементом во вселенной. Он обладает свойствами металла: высокой теплопроводностью, электропроводностью и пластичностью. Водород является главным компонентом звезд, включая наше Солнце.
Одним из важных свойств водорода является его способность реагировать с кислородом в воде. При взаимодействии между металлом и водой происходит окислительно-восстановительная реакция, в результате которой водород освобождается в виде газа.
Водородный газ, полученный при взаимодействии металла с водой, может быть использован в различных областях: водородные топливные элементы, производство аммиака, производство водородной пероксида и других веществ. Водород также может использоваться в качестве питания для ракетных двигателей и спасательных систем.
Таким образом, водород является активным и важным металлом, способным реагировать с водой и образовывать полезные вещества для различных областей человеческой деятельности.
Главное взаимодействие водорода - с водой

Водород, как самый легкий элемент, обладает огромной реакционной активностью и образует соединения с большинством элементов периодической системы. Но главное и наиболее известное взаимодействие водорода происходит с водой.
Взаимодействие водорода с водой является реакцией основного характера. Оно бывает различным в зависимости от условий. При нормальных условиях вода в реакции с водородом превращается в пар и сопровождается выделением большого количества теплоты. Реакция может быть представлена следующим образом: H2 + H2O → 2H2O + теплота.
Возможность реакции водорода с водой объясняется тем, что окислительные свойства воды позволяют ей отдавать электроны. При взаимодействии с водой атомы водорода отделяются от молекулы H2 и участвуют в реакции окисления. В результате этой реакции образуется ион гидроксида OH- и высвобождается молекула воды. Данное взаимодействие позволяет использовать водород в различных технических процессах.
Химическое уравнение реакции металла с водой
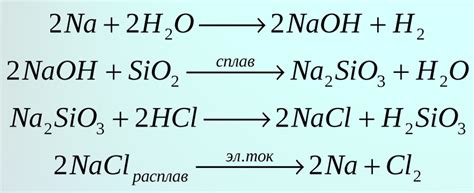
Реакция активного металла с водой является одной из характерных химических реакций, которые происходят при взаимодействии металлов с веществами окружающей среды. При этом происходит образование гидроксида металла и выделение водорода. Такая реакция может быть представлена следующим химическим уравнением:
Металл + Вода → Гидроксид металла + Водород
Примером металла, который образует гидроксид и выделяет водород при взаимодействии с водой, является натрий:
2Na + 2H2O → 2NaOH + H2
В данной реакции натрий (Na) реагирует с водой (H2O) и образует гидроксид натрия (NaOH) и молекулы водорода (H2). Реакция сопровождается выделением газообразного водорода и образованием щелочного раствора гидроксида натрия.
Подобные реакции взаимодействия активных металлов с водой протекают при обычных условиях и их скорость может зависеть от ряда факторов, включая активность металла, температуру и концентрацию воды. Такие реакции являются важными для химической промышленности и исследований в области химии металлов.
Механизм взаимодействия и образование гидридов

Активный металл - это металл, способный реагировать с другими веществами. Вода, являясь одним из наиболее распространенных веществ на Земле, является хорошим объектом для исследования взаимодействия с активными металлами. Один из таких металлов - натрий. При контакте с водой активный металл идет в реакцию, образуя гидриды.
Механизм взаимодействия активного металла с водой состоит из нескольких этапов. Сначала активный металл вступает в контакт с молекулами воды. При этом происходит ионизация металла, то есть его атомы потеряют электроны и превратятся в положительно заряженные ионы. Эти ионы соединяются с соответствующими отрицательно заряженными ионами воды, образуя гидриды.
Гидриды - это соединения, состоящие из металлических ионов и молекул воды. Они обладают специфическими свойствами и могут быть использованы в различных промышленных процессах. Например, гидриды активных металлов могут быть использованы в качестве катализаторов при химических реакциях. Они также могут служить источником водорода - важного энергетического ресурса.
Термические и физические свойства водорода

Термические свойства:
Температура кипения: Водород кипит при очень низкой температуре – около -252,87°C (или при давлении 1 атмосферы). При этой температуре молекулы водорода превращаются в пары.
Температура плавления: У водорода очень низкая температура плавления – около -259,16°C (или при давлении 1 атмосферы). При этой температуре молекулы водорода располагаются в решетке и становятся жидкими.
Теплоемкость: Теплоемкость водорода очень низкая – около 14,3 Дж/(моль·К). Это означает, что при добавлении определенной энергии водород нагревается медленнее, чем другие вещества с высокой теплоемкостью.
Физические свойства:
Плотность: Водород имеет очень низкую плотность – 0,089 г/л. Из-за этого воздух является более плотным, чем газообразный водород, поэтому водород стремится всплывать в атмосфере.
Растворимость: Водород плохо растворяется в водах – 14,6 мл (при 15°C) растворяется около 1 г водорода. При этом концентрация растворенного водорода в воде не превышает 0,001 моль/л.
Электрическая проводимость: Хотя водород не является проводником электричества в обычных условиях, при очень высоких температурах или низких давлениях он может стать полупроводником.
Применение водорода в современных технологиях
Водород - универсальное химическое вещество, которое играет важную роль в современных технологиях. Он широко применяется в различных отраслях науки и промышленности благодаря своим уникальным химическим свойствам.
Производство электроэнергии: Одним из главных применений водорода является использование его в энергетике, особенно водородные топливные элементы (ВТЭ). ВТЭ являются чистыми источниками энергии, так как при их работе происходит только реакция между водородом и кислородом, без выброса вредных веществ.
Хранение и транспортировка энергии: Водород имеет большой потенциал в качестве носителя энергии. Он может быть использован для хранения электрической энергии, которую можно использовать в будущем. Также водород может быть транспортирован газопроводами или использоваться в процессе сжижения для дальнейшей доставки как топливо для автомобилей и других транспортных средств.
Процессы разделения и синтеза: Водород применяется в процессах разделения и синтеза различных химических веществ. Он может быть использован для производства аммиака, который является основным компонентом удобрений. Также водород используется при промышленном производстве различных органических соединений.
Электролиз воды: Электролиз воды - это процесс разложения воды на кислород и водород с помощью электрического тока. Этот процесс является важным источником водорода, который может быть использован в различных промышленных процессах и технологиях. Кроме того, электролиз воды также является одним из способов хранения и использования избыточной электрической энергии, произведенной в периоды пикового спроса.
В заключение, водород имеет широкий потенциал в современных технологиях и может сыграть ключевую роль в развитии экологически чистых и эффективных источников энергии. Применение водорода в различных областях науки и промышленности может помочь снизить зависимость от нефти и угля и сделать наш мир более устойчивым и экологически чистым.
Выводы из взаимодействия металла с водой

Взаимодействие активного металла с водой происходит с выделением водорода и образованием щелочи. Эта реакция является реакцией окисления-восстановления, в которой металл окисляется, а вода восстанавливается. В результате этой реакции происходит изменение свойств и состава исходных веществ.
В процессе взаимодействия металла с водой происходит выделение газообразного водорода и образование гидроксида металла. Гидроксид металла является щелочным веществом и обладает высокой щелочностью. Это вызвано тем, что гидроксиды металлов - это продукты реакции металла с водой, а вода сама по себе является нейтральным веществом.
При взаимодействии металла с водой отмечается высокая активность металла. Активные металлы активно вступают в химические реакции, что связано с их способностью отдавать электроны и образовывать положительные ионы. В процессе взаимодействия активного металла с водой реализуется реакция окисления-восстановления. Металл окисляется, отдавая свои электроны воде, а вода восстанавливается, принимая эти электроны. Такое взаимодействие приводит к возникновению электротонной реакции, которая сопровождается образованием строго определенного количества газообразного водорода и щелочи.
Выделение водорода при взаимодействии активного металла с водой является важным процессом в различных областях науки и техники. Водород обладает высокими энергетическими характеристиками и считается перспективным источником энергии. Также водород используется в различных химических процессах и промышленных производствах, в том числе в производстве аммиака и металлов.
Вопрос-ответ

Какие металлы активно взаимодействуют с водой?
Среди активных металлов, которые активно взаимодействуют с водой при нормальных условиях, можно выделить литий (Li), натрий (Na), калий (K) и рубидий (Rb).
Что происходит при взаимодействии активных металлов с водой?
При взаимодействии активного металла с водой происходит химическая реакция, при которой металл реагирует с водой, образуя гидроксид металла и выделяя водород.
Какие свойства имеют активные металлы?
Активные металлы обладают высокой активностью, что означает их способность активно взаимодействовать с другими веществами, в том числе с водой и кислородом. Они также обладают низкой плотностью, низкой температурой плавления и высокой проводимостью электричества и тепла.
Какую роль играют активные металлы в природе?
Активные металлы играют важную роль в природе. Например, натрий и калий являются необходимыми элементами для живых организмов, входят в состав многих биологически активных молекул. Литий используется в производстве аккумуляторов, а рубидий в научных исследованиях.
Какие меры безопасности необходимо соблюдать при работе с активными металлами?
При работе с активными металлами необходимо соблюдать определенные меры безопасности. Например, работать в хорошо проветриваемом помещении или под вытяжкой, носить защитные очки и рукавицы, не приближаться к ячейкам с активными металлами слишком близко и т.д. Также необходимо соблюдать правила пожарной безопасности, так как активные металлы могут быть горючими.
