Активные металлы являются одной из важных групп элементов в химии. Они обладают рядом уникальных свойств, которые делают их незаменимыми во многих процессах и реакциях. В этой статье мы рассмотрим полный список активных металлов и изучим их основные характеристики.
Активные металлы - это элементы периодической системы, которые обладают высокой химической активностью. Они имеют малую энергию ионизации и электроотрицательность, что делает их хорошими восстановителями и реагентами в химических реакциях. В то же время, их высокая реакционная способность может вызывать такие явления, как окисление и коррозия.
Среди активных металлов можно выделить несколько основных элементов. К ним относятся литий, натрий, калий, магний, алюминий, цинк, железо, медь и другие. Каждый из этих элементов обладает своими уникальными свойствами и применяется в различных областях науки и промышленности.
Например, литий широко используется в производстве аккумуляторов, благодаря своим высоким энергетическим характеристикам. Алюминий является одним из основных материалов в строительстве и авиационной промышленности благодаря своей легкости и прочности.
Осознание свойств и применения активных металлов в химии помогает нам лучше понять их уникальные характеристики и возможности. Это, в свою очередь, способствует развитию более эффективных и экологически безопасных химических процессов и технологий.
Щелочные металлы: свойства и химические реакции

Щелочные металлы представляют собой группу химических элементов, которые имеют очень низкую электроотрицательность и высокую активность. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Свойства щелочных металлов в основном определяются их низкими энергиями ионизации и положительными зарядами ионов, которые они образуют. Они мягкие и легко реагируют с водой, кислородом и несколькими другими веществами.
Щелочные металлы обладают высокой химической активностью, что делает их хорошими окислителями. Они обычно образуют ионы с положительным зарядом, просто отдавая свои внешние электроны. Это делает их высоко реакционноспособными и способными образовывать соли с отрицательно заряженными ионами.
Самой характерной реакцией щелочных металлов является их реакция с водой. При контакте с водой они активно реагируют, образуя гидроксиды щелочных металлов и высвобождая водород. Реакция происходит экзотермически, с выделением большого количества тепла.
Другой интересной химической реакцией щелочных металлов является их реакция с кислородом. Они реагируют с кислородом из воздуха, образуя оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) и другие. Эти оксиды могут быть использованы в различных промышленных процессах, включая производство стекла и керамики.
Щелочноземельные металлы: особенности и применение

Щелочноземельные металлы - это группа элементов, которая расположена во второй группе периодической таблицы. К ним относятся бериллий, магний, кальций, стронций, барий и радий. Они имеют сходные свойства и обладают рядом особенностей, которые делают их полезными в различных сферах нашей жизни.
Особенности щелочноземельных металлов включают высокую жаростойкость и способность образовывать стабильные соединения с другими элементами. Они легкие, хорошо термически и электрически проводят, а также обладают высокой пластичностью.
Эти металлы широко применяются в различных областях. Например, бериллий используется в производстве аэрокосмической техники, благодаря своим легким, но прочным свойствам. Магний используется в автомобильной промышленности, так как он является легким и прочным материалом для изготовления компонентов автомобилей.
Кальций является важным элементом для здоровья человека. Он участвует в формировании костей и зубов, а также регулирует сердечный ритм и сокращение мышц. Стронций применяется в производстве пиротехнических изделий, благодаря своей способности выделять яркий красный цвет при горении.
Барий применяется в медицине для рентгенологических исследований, так как его соединения имеют высокую поглощающую способность для рентгеновского излучения. Радий, несмотря на свою высокую радиоактивность, используется в производстве светящихся элементов для часов, индикаторов и геигеровсчетчиков.
Таким образом, щелочноземельные металлы обладают уникальными свойствами и находят применение в различных отраслях нашей жизни, от промышленности до медицины и космоса.
Полынные металлы: физические свойства и вещества
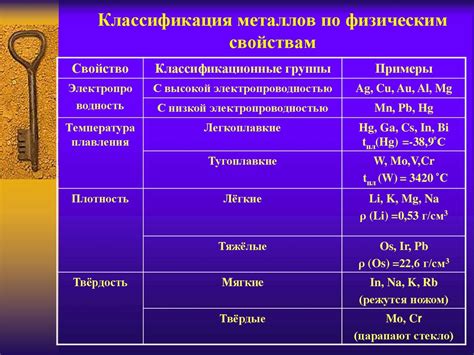
Полынные металлы являются особой группой активных металлов, которые имеют ряд уникальных физических свойств и химических реакций. Они отличаются высокой реакционной способностью и активностью, что делает их важным элементом во многих химических процессах.
Одной из ключевых характеристик полынных металлов является их низкая плотность. Они обладают относительно небольшой массой по сравнению с объемом, что делает их легкими и пластичными. Это свойство позволяет использовать полынные металлы в различных областях, включая авиацию, строительство и электронику.
Веществами, на основе полынных металлов, являются сплавы, которые обладают уникальными свойствами. Они часто используются в производстве металлических конструкций, инструментов и оборудования. Полынные металлы также часто используются в химической промышленности в качестве катализаторов для различных реакций.
Отдельно стоит выделить реактивность полынных металлов. Они легко взаимодействуют с другими элементами и соединениями, образуя соли и сплавы. Это позволяет использовать полынные металлы для выделения других веществ, а также проведения различных химических превращений. Однако, из-за их высокой реакционной способности, полынные металлы требуют особого хранения и обработки.
Итак, полынные металлы обладают рядом уникальных физических свойств и веществ, что делает их важными элементами во многих отраслях промышленности и науки. Их высокая реакционная способность требует особого внимания при использовании в химических процессах.
Редкоземельные металлы: влияние на окружающую среду

Редкоземельные металлы - это группа химических элементов, которые обладают уникальными свойствами и широким спектром применения. Однако их добыча и использование также оказывают влияние на окружающую среду.
Добыча редкоземельных металлов ведется преимущественно методом рудоносных пород, что приводит к значительной нагрузке на природные ресурсы. Разрушение природной среды и нарушение экосистемы являются последствиями этого процесса. Кроме того, в процессе добычи редкоземельных металлов выделяются токсичные вещества, такие как железо, свинец и радиоактивные изотопы, которые могут представлять опасность для флоры и фауны.
Когда редкоземельные металлы используются в производстве, выделяются отходы и выбросы, которые могут быть вредными для окружающей среды и здоровья людей. Неконтролируемое сжигание или складирование отходов может привести к загрязнению почвы, воды и воздуха.
Кроме того, добыча редкоземельных металлов требует большого количества энергии, что приводит к выбросу парниковых газов и усилению глобального потепления. Ученые и экологи призывают к разработке более экологически чистых методов добычи и использования редкоземельных металлов.
Все эти факторы указывают на необходимость разработки устойчивых и эффективных систем управления добычей, использованием и утилизацией редкоземельных металлов. Только так можно минимизировать их негативное воздействие на окружающую среду и обеспечить устойчивое развитие.
Переходные металлы: свойства и использование в промышленности

Переходные металлы - это элементы, расположенные в середине периодической таблицы, между группами основных и инертных элементов. Они обладают рядом уникальных свойств, которые делают их особенно полезными в промышленности.
Одним из основных свойств переходных металлов является их высокая химическая активность. Они легко вступают в химические реакции, образуя стабильные соединения с другими элементами. Благодаря этому, переходные металлы широко используются в процессе катализа, в особенности в промышленности нефтехимии и производстве пластмасс. Кроме того, они эффективно участвуют в электролизе, что позволяет использовать их как катоды и аноды в различных процессах.
Еще одним важным свойством переходных металлов является их способность образовывать различные оксиды и соединения с кислородом. Это делает их незаменимыми в производстве керамики, стекла и красок. Переходные металлы также широко используются в производстве металлургических и легированных материалов, таких как сталь и сплавы.
Среди переходных металлов можно выделить несколько особо важных элементов, таких как железо, никель, медь и цинк. Железо, например, является основным компонентом в производстве стали, которая широко используется в строительстве и машиностроении. Никель и медь применяются в производстве электронных компонентов, а цинк используется в производстве батареек и в процессе гальванизации.
Выводящаяся списком информация:
- Переходные металлы - это элементы, расположенные в середине периодической таблицы
- Одним из основных свойств переходных металлов является их высокая химическая активность
- Переходные металлы широко используются в процессе катализа и электролиза
- Переходные металлы важны для производства керамики, стекла, красок и металлургических материалов
- Железо, никель, медь и цинк - особенно важные переходные металлы
Алюминий и его соединения: применение и производство

Алюминий – активный металл, который широко используется в различных отраслях народного хозяйства благодаря его свойствам и прочности. Одним из основных применений алюминия является производство конструкционных материалов. Алюминиевые сплавы обладают высокой прочностью, низким весом и хорошей коррозионной стойкостью, благодаря чему они широко используются в авиационной, автомобильной и судостроительной промышленности.
Помимо этого, алюминий находит применение в электротехнике. Он используется для изготовления проводов и кабелей, так как обладает низким электрическим сопротивлением и отличной электропроводностью. Кроме того, алюминий используется в производстве резисторов и конденсаторов, его соединения применяются в электронных устройствах и полупроводниковой промышленности.
Еще одной сферой применения алюминия является упаковка продуктов. Алюминиевая фольга обладает высокой устойчивостью к воздействию влаги, света и кислорода, что позволяет ей сохранять свежесть и качество продуктов. Алюминиевые банки и бутылки используются для упаковки напитков, косметических и фармацевтических препаратов.
Кроме того, алюминий и его соединения находят применение в строительстве, пищевой промышленности, химической промышленности, медицине и многих других отраслях. Благодаря своим уникальным свойствам и широким применениям, алюминий является одним из самых востребованных и значимых элементов в современной промышленности.
Цинк и его соединения: роль в органической химии

Цинк – один из активных металлов, который широко используется в органической химии. Он обладает рядом уникальных свойств и способностей, благодаря чему он находит применение во многих областях.
Соединения цинка играют важную роль в органической химии. Например, цинк-органические соединения применяются в качестве катализаторов в реакциях синтеза органических веществ. Они обладают высокой активностью и способностью ускорять химические реакции, что делает их очень востребованными в промышленности и лабораторных условиях.
Цинк-органические соединения также применяются в процессах литейного производства. Они обеспечивают надежную защиту от коррозии и повышают прочность материалов. В результате, изделия из цинковых сплавов обладают долговечностью и стойкостью к внешним воздействиям.
Цинк играет значимую роль и в фармацевтической промышленности. Его соединения используются в процессе синтеза лекарственных препаратов. Например, цинк может служить активным компонентом в составе некоторых противовоспалительных и противомикробных средств. Благодаря своим антибактериальным свойствам, цинк помогает бороться с различными инфекционными заболеваниями.
В заключение, цинк и его соединения играют важную роль в органической химии. Они выполняют функции катализаторов, защищают материалы от коррозии, а также применяются в производстве лекарственных препаратов. Благодаря своим свойствам цинк находит широкое применение в различных областях и является неотъемлемой частью современной химической промышленности.
Свинец и его свойства: применение и вредность

Свинец (Pb) – активный металл из группы элементов с p-с или s-блоками периодической системы химических элементов. Он обладает хорошей пластичностью, водоплавкостью и низкой твердостью. Из натуральных соединений свинца наиболее распространены сульфид и оксид, а также соли, например, нитрат, хлорид и ацетат свинца.
Свинец широко применяется в различных отраслях промышленности. В автомобильной промышленности свинец используется в производстве аккумуляторных батарей и стабилизаторов добавки к топливу. Он также используется в производстве снарядов, мушек, каркасных деталей кровельных покрытий и многих других изделий. В медицине свинец используется для создания защитных пластырей и лекарственных препаратов.
Несмотря на широкое применение, свинец является ядовитым металлом. Он может накапливаться в организме человека и вызывать серьезные заболевания. Особую опасность представляет образование соединений свинца во внутренних органах, что может привести к отравлению нервной системы, нарушениям иммунной системы и заболеваниям органов крови. Особенно подвержены риску отравления свинцом дети, беременные женщины и люди, работающие на опасных производствах.
В связи с высокой вредностью свинца, в различных странах мира принимаются меры по сокращению его использования и контролю за его попаданием в окружающую среду. Однако, необходимо помнить о возможных опасностях и предпринимать все меры предосторожности при работе с свинцом, чтобы минимизировать риск отравления.
Вопрос-ответ

Какие металлы относятся к активным металлам?
К активным металлам относятся щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) и щелочноземельные металлы (бериллий, магний, кальций, стронций, барий, радий).
Какие свойства характеризуют активные металлы?
Активные металлы обладают высокой реакционной способностью, они активно взаимодействуют с водой, кислородом, кислотами и даже некоторыми неметаллами. Они обычно отдают электроны, образуя ионы положительной заряды.
Какие свойства щелочных металлов?
Щелочные металлы характеризуются низкой плотностью, низким плавлением и кипением, мягкостью, серебристо-белым цветом. Они легко реагируют с водой, образуя щелочные растворы. Щелочные металлы имеют один электрон во внешней энергетической оболочке.
Какие свойства щелочноземельных металлов?
Щелочноземельные металлы имеют высшую плотность, тугоплавкость, твердость и прочность по сравнению с щелочными металлами. Они образуют ионы с двойной положительной зарядом и имеют два электрона во внешней энергетической оболочке.
Какие реакции металлов с водой?
Щелочные металлы (натрий, калий) реагируют с водой, образуя гидроксиды и выделяя водород. Реакция щелочных металлов с водой является очень быстрой и сопровождается образованием пламени. Щелочноземельные металлы медленно реагируют с водой, но могут реагировать с паром воды при нагревании.
