Металлы - это элементы, которые характеризуются высокой электропроводностью, гибкостью и хорошей термической и электрической проводимостью. Однако не все металлы одинаково активны и способны взаимодействовать с другими веществами. Это связано с рядом факторов, которые определяют степень активности металла.
Один из важных факторов, определяющих активность металла, это его электрохимический потенциал. Электрохимический потенциал - это мера способности металла отдать или принять электроны. Чем выше электрохимический потенциал металла, тем более активным он является. Например, калий имеет низкий электрохимический потенциал и является очень активным металлом, в то время как золото имеет высокий электрохимический потенциал и считается малоактивным металлом.
Второй фактор, определяющий активность металла, это его способность образовывать соединения. Некоторые металлы образуют стабильные и инертные соединения, что делает их малоактивными. Например, серебро, платина и золото образуют стабильные оксиды, которые защищают металл от окисления и предотвращают его активное взаимодействие с другими веществами. С другой стороны, некоторые металлы, например, натрий и калий, образуют легко разрушаемые оксиды, что делает их очень активными.
Третий фактор, влияющий на активность металла, это его положение в ряду напряжений электрохимической активности. Ряд напряжений электрохимической активности представляет собой упорядоченный список металлов по их активности. Металлы в самом верху этого ряда, включая литий, калий, натрий и кальций, являются наиболее активными и способными взаимодействовать с другими веществами. Металлы в нижней части ряда, такие как серебро, платина и золото, являются менее активными.
Важно отметить, что активность металла может быть изменена в зависимости от условий окружающей среды и наличия других веществ. Например, металлы могут проявлять активность в кислой среде, но быть малоактивными в щелочной среде. Также активность металла может изменяться при повышении температуры или добавлении химических реагентов.
Активность металлов и ее причины

Металлы - это химические элементы, обладающие способностью активно взаимодействовать с другими веществами. Их активность определяется несколькими факторами.
Во-первых, активность металлов зависит от электрохимического потенциала. Каждый металл имеет свое электрохимическое напряжение, которое может быть положительным или отрицательным. Металлы с высоким положительным потенциалом, такие как литий и калий, являются очень активными и с легкостью вступают в химические реакции. Наоборот, металлы с низким отрицательным потенциалом, например, золото и платина, менее активны и обладают высокой стойкостью к окислению.
Во-вторых, активность металлов зависит от их положения в ряду активности. Ряд активности металлов представляет собой упорядоченный список металлов по их способности вступать в реакции с кислородом или другими веществами. Чем дальше в ряду находится металл, тем выше его активность. Например, натрий и калий расположены выше в ряду, чем железо и свинец, и поэтому более активны.
Кроме того, активность металлов может быть повышена или понижена в зависимости от условий окружающей среды. Например, металлы могут проявлять активность при определенной температуре или в определенных реакционных средах. Некоторые металлы, такие как алюминий и цинк, образуют защитные оксидные пленки на своей поверхности, которые помогают предотвратить дальнейшую коррозию и сохранить их активность.
Таким образом, активность металлов определяется их электрохимическим потенциалом, положением в ряду активности и условиями окружающей среды. Понимание этих факторов позволяет определить, какой металл будет наиболее подходящим для конкретной химической или технической задачи.
Коррозия металлов как проявление активности
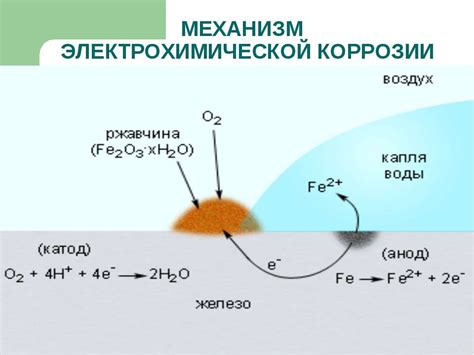
Коррозия металлов является одним из наиболее распространенных проявлений их химической активности. Этот процесс происходит под воздействием агрессивных сред, таких как вода, влажный воздух, различные вещества, присутствующие в окружающей среде. Коррозия приводит к разрушению металлов, снижению их прочности и ухудшению внешнего вида.
В процессе коррозии металлов активность проявляется через взаимодействие с окружающей средой. Активные металлы, такие как железо, алюминий или цинк, обладают высокой способностью к химическому взаимодействию. При контакте с агрессивными средами происходит электрохимическая реакция, в результате которой металлы теряют электроны и превращаются в соединения с окружающими веществами.
Одним из важных факторов, определяющих интенсивность коррозии, является рН среды. В щелочной среде (рН>7) металлы обычно коррозируют медленнее или вовсе не подвергаются коррозии, так как окружающая среда нейтрализует их активность. Однако, в кислой среде (рН
- Также играет роль содержание влаги в окружающей среде. Влажность способствует ускорению коррозии. Влага обеспечивает постоянную среду для электрохимических реакций и ускоряет диффузию реагентов. Таким образом, влажная атмосфера или наличие воды на поверхности металла увеличивают скорость разрушения металла под воздействием окружающей среды.
- Металлы также могут быть подвержены коррозии при контакте с другими металлами. При взаимодействии двух разных металлов в окружающей среде между ними возникает электрохимический элемент. В результате возникает анодно-катодная пара, где один металл действует как анод (подвержен коррозии), а другой - как катод (не подвержен коррозии).
В результате коррозии металлы теряют свою первоначальную структуру и свойства, что может привести к серьезным последствиям. Поэтому очень важно искать способы предотвращения коррозии металлов и принимать меры по их защите от агрессивного воздействия окружающей среды.
Температура и ее влияние на активность металлов

Температура является одним из основных факторов, которые определяют активность металлов. Повышение или понижение температуры может значительно влиять на физические и химические свойства металлов, а следовательно, на их активность.
При повышении температуры, активность металлов обычно возрастает. Это связано с тем, что при более высоких температурах увеличивается энергия частиц, что способствует более интенсивным химическим реакциям. Многие металлы становятся более реактивными при нагревании и могут легче вступать в реакцию с другими веществами.
Однако, некоторые металлы могут иметь обратную зависимость активности от температуры. Например, при повышении температуры алюминий может покрываться пассивной оксидной пленкой, которая защищает его от преждевременного разрушения и снижает его активность. Также, некоторые металлы могут подвергнуться термической дезактивации, когда при высоких температурах происходит изменение их структуры и свойств, что ведет к снижению активности.
Температура также оказывает влияние на скорость реакций между металлами и другими веществами. При повышении температуры, коллизии между металлическими атомами и атомами других веществ становятся более энергичными, что приводит к ускорению химических реакций. Однако, при очень высоких температурах некоторые реакции могут замедляться или полностью прекращаться из-за угасания каталитической активности металлов.
В целом, температура является важным фактором, который может явно или неявно влиять на активность металлов. Взаимодействие между температурой и металлами должно учитываться при проведении химических реакций и применении металлов в различных сферах, таких как производство, электротехника, металлургия и другие.
Взаимодействие с окружающей средой и активность металлов

Взаимодействие металлов с окружающей средой является одним из основных факторов, определяющих их активность. Окружающая среда может значительно влиять на процессы окисления и восстановления металлов, а также на их растворимость и реакционную способность.
Одним из наиболее распространенных проявлений взаимодействия металлов с окружающей средой является их коррозия. Коррозия – это процесс разрушения и растворения металлов под действием химических реакций с веществами окружающей среды. Вода, влажность, кислород, кислоты и щелочи могут вызывать коррозию металлов, что приводит к потере их структурной прочности и затратам на ремонт и замену деталей.
Кроме того, активность металлов может быть определена их способностью образовывать соединения с другими веществами в окружающей среде. Некоторые металлы образуют стабильные соединения, что делает их менее реакционноспособными. Другие металлы, напротив, обладают высокой реакционной способностью и могут образовывать разнообразные соединения с окружающей средой.
Важным фактором, влияющим на взаимодействие металлов с окружающей средой, является pH-уровень среды. Он может определять направление реакции окисления или восстановления металлов. Например, при низком pH металлы склонны к окислению и коррозии, а при высоком pH – к восстановлению и образованию инертных соединений.
Электрохимические свойства, влияющие на активность металлов
Активность металлов зависит от их электрохимических свойств, которые определяются взаимодействием среды с поверхностью металла. Одним из основных факторов, влияющих на активность металлов, является их реакция с водой, которая может протекать в разных режимах: с выделением водорода или без него.
Металлы, которые активно реагируют с водой с выделением водорода, называются активными. Эта реакция осуществляется посредством окисления металла, при котором ионы металла переходят в раствор, а электроны отделяются от металла и передаются на воду, которая в результате разлагается на молекулярный водород и гидроксидные ионы.
Другой важной характеристикой электрохимического взаимодействия металлов является потенциал окисления (или потенциал растворения). Он определяет, насколько активно металл окисляется или растворяется во взаимодействии с окружающей средой. Чем выше потенциал окисления металла, тем активнее он будет реагировать.
Кроме того, влияние на активность металлов оказывает их электропроводность. Металлы, обладающие высокой электропроводностью, будут активнее реагировать с окружающей средой, так как они способны легче передавать электроны между атомами.
Таким образом, электрохимические свойства металлов, такие как реакция с водой, потенциал окисления и электропроводность, являются важными факторами, определяющими их активность. Понимание и учет этих свойств позволяют предсказывать поведение металлов в различных условиях и использовать их с учетом их активности.
Структура и активность металлов

Металлы обладают особым строением, которое определяет их химическую активность. Одной из характеристик, влияющих на активность металлов, является электронная структура.
Атомы металлов обладают общей чертой - наружный слой электронов заполнен не полностью. Именно эти электроны играют важную роль в активности металлов. Они легко участвуют в химических реакциях, образуя ионы с положительным зарядом.
Еще одним фактором, который влияет на активность металлов, является их электроотрицательность. Металлы обладают низкой электроотрицательностью, что позволяет им легко отдавать электроны и образовывать положительно заряженные ионы.
Также для определения активности металлов важны их размеры. Маленькие металлы обладают большей активностью, чем большие. Это связано с более сильным притяжением электронов ядрами в маленьких атомах и, как следствие, большей энергией при реакциях с другими веществами.
Влияние восприимчивости металлов к кислороду на их активность

Восприимчивость металлов к кислороду является одним из ключевых факторов, определяющих их активность. Процесс взаимодействия металлов с окружающей средой является химической реакцией, и при этом происходит образование оксидов металлов. Восприимчивость металлов к кислороду определяет, насколько быстро и интенсивно происходит реакция с оксигенацией.
Чем выше восприимчивость металла к кислороду, тем больше вероятность его активности. Кроме того, активность металлов также связана с их электрохимическим потенциалом, который определяет скорость протекания реакции окисления. Металлы с более высоким электрохимическим потенциалом обладают большей активностью и более быстрой реакцией с кислородом.
Одним из ярких примеров металла с высокой восприимчивостью к кислороду и высокой активностью является натрий. Натрий очень реактивен с кислородом и легко окисляется в воздухе, образуя пленку оксида натрия на поверхности. Наоборот, металлы с низкой восприимчивостью к кислороду, такие как золото и платина, обладают низкой активностью и не окисляются на воздухе.
Влияние восприимчивости металлов к кислороду на их активность является существенным в различных отраслях промышленности. Например, в процессе коррозии металлов, высокая восприимчивость металлов к кислороду может привести к быстрой коррозии и разрушению конструкций. Поэтому важно учитывать этот фактор при выборе материалов для использования в агрессивных средах.
Вопрос-ответ

Какие факторы определяют активность металлов?
Активность металлов зависит от таких факторов, как их электрохимический потенциал, атомная структура, наличие свободных электронов в валентных оболочках и внешние условия, включая температуру и окружающую среду.
Как влияет электрохимический потенциал на активность металлов?
Электрохимический потенциал является мерой способности металла отдавать или принимать электроны. Металлы с более высокими значениями электрохимического потенциала обладают большей активностью и способностью окисляться, тогда как металлы с более низкими значениями электрохимического потенциала склонны восстанавливаться.
Как внешние условия влияют на активность металлов?
Температура окружающей среды может влиять на активность металлов, поскольку в процессе окисления или восстановления металлов требуется энергия. Высокая температура может активировать реакцию окисления металла, тогда как низкая температура может замедлить реакцию. Кроме того, окружающая среда, включая влагу и агрессивные химические вещества, может также влиять на активность металлов.
Как атомная структура влияет на активность металлов?
Атомная структура металлов определяет их способность отдавать или принимать электроны. Например, металлы с большими атомами, у которых слабая связь между атомами, обычно имеют большую активность, так как они легче отдают электроны. Кроме того, количество свободных электронов в валентных оболочках также влияет на активность металлов.
