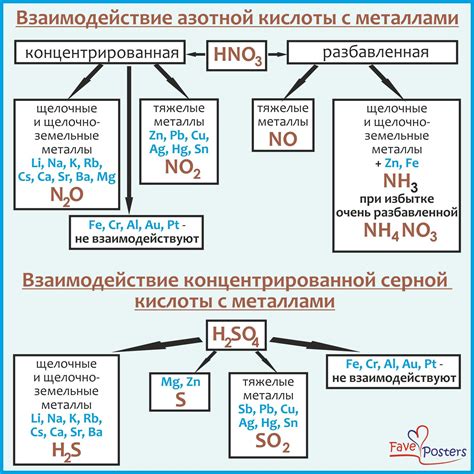
Щелочные среды обладают высоким уровнем щелочности и могут взаимодействовать с различными материалами, включая металлы. Такое взаимодействие может иметь важное значение в различных промышленных процессах, а также быть причиной повреждений и коррозии металлических изделий.
Особенностью взаимодействия щелочной среды с металлами является их способность образовывать гидроксиды, которые могут растворяться в воде. В результате этого происходит образование растворов, содержащих ионы металла и гидроксидные ионы. Эти растворы могут обладать высокой щелочностью и химической активностью, что может приводить к различным эффектам на поверхности металла.
Примерами взаимодействия щелочной среды с металлами являются процессы лужения, гальванического осаждения и электрохимического оксидирования. Лужение — это процесс, при котором поверхность металла покрывается слоем щелочных растворов, что способствует его защите от коррозии и улучшает внешний вид. Гальваническое осаждение представляет собой процесс нанесения металлического покрытия на поверхность металла с помощью электронного тока, а электрохимическое оксидирование — это процесс образования окисленного слоя на поверхности металла при его взаимодействии с щелочными растворами.
Взаимодействие щелочной среды с металлами
Щелочная среда, характеризующаяся высоким pH, оказывает определенное влияние на металлы. Взаимодействие между ними может привести к различным процессам, таким как окисление, растворение и образование осадков.
Металлы, особенно активные металлы, такие как натрий, калий и литий, реагируют с щелочными растворами, образуя гидроксиды металлов. Это происходит благодаря отрицательному окислительному потенциалу металла и высокому pH щелочной среды.
Некоторые металлы могут растворяться в щелочных растворах с образованием комплексных ионов. Например, вода может растворять цинк в щелочной среде, образуя цинкатные ионы. Этот процесс можно наблюдать при растворении цинка в горячем растворе гидроксида натрия.
Щелочные растворы также могут вызывать окисление металлов. Например, водород может окислиться до гидроксида натрия или калия. Это видно, когда металлический натрий или калий растворяются в воде или щелочи.
Более реактивные металлы, такие как алюминий и магний, могут проявлять специфическую реакцию с щелочными растворами. Алюминий, например, может образовывать алюминатные ионы, которые далее могут образовывать осадки гидроксида алюминия.
Особенности взаимодействия

Взаимодействие щелочной среды с металлами имеет свои особенности, которые необходимо учитывать при проведении химических реакций.
Во-первых, щелочная среда способна разрушать металлы, вызывая их коррозию. Это связано с тем, что щелочи обладают высокой активностью и могут образовывать ионы, которые реагируют с поверхностью металла, вызывая ее разрушение.
Во-вторых, при взаимодействии щелочной среды с металлами может происходить выделение газов. Например, при реакции щелочи с алюминием выделяется водород. Это явление может привести к образованию пузырьков или других газовых образований в реакционной смеси.
Кроме того, взаимодействие щелочей с металлами может протекать с образованием солей. Например, при реакции щелочи с железом образуется гидроксид железа, который в дальнейшем может реагировать с другими соединениями щелочи и образовывать соли.
Важно отметить, что взаимодействие щелочной среды с металлами может зависеть от концентрации щелочи, температуры и других факторов. Поэтому при проведении химических экспериментов необходимо учитывать эти особенности и обеспечивать безопасные условия работы.
Примеры взаимодействия

Щелочная среда может привести к различным химическим реакциям с металлами. Например, при контакте щелочной среды с алюминием происходит реакция образования соли алюмината и выделения водорода:
Реакция: 2Al + 2 NaOH + 6H2O -> 2 Na[Al(OH)4] + 3H2
Результат: В результате реакции образуется соль натрия алюмината и выделяется водород.
Другим примером является взаимодействие щелочи с железом. При этом образуется гидроксид железа и выделяется водород:
Реакция: 2 Fe + 2 NaOH + 4H2O -> 2 Na[Fe(OH)4] + H2
Результат: Реакцией получается соль натрия гидроксида железа и выделяется водород.
Наиболее интенсивное взаимодействие металлов с щелочной средой происходит с металлами щелочных металлов (натрий, калий, литий), поскольку они образуют соль и водород:
Реакция: 2 Na + 2 H2O -> 2 NaOH + H2
Результат: В результате реакции получается щелочная соль и выделяется водород.
Таким образом, взаимодействие щелочной среды с металлами может приводить к образованию солей и выделению водорода, что может иметь важные практические применения, например, в процессах обезжиривания и очистки металлических поверхностей.
Вопрос-ответ

Какие опасности могут возникнуть при взаимодействии щелочной среды с металлами?
Взаимодействие щелочной среды с металлами может привести к ряду опасностей. Например, образованию взрывоопасных соединений, выделению вредных газов, разрушению металлических конструкций и электродов, а также возгоранию. Поэтому необходимо соблюдать меры предосторожности при работе с щелочными растворами и металлами.
Какие металлы образуют стабильные соединения с щелочными растворами?
Некоторые металлы могут образовывать стабильные соединения с щелочными растворами. В частности, алюминий, цинк, железо, медь и никель могут растворяться в щелочной среде с образованием ионов металла в растворе. Это связано с тем, что эти металлы обладают достаточной химической активностью для вступления в реакцию с щелочными компонентами.
Какой механизм взаимодействия металлов с щелочными растворами?
Основной механизм взаимодействия металлов с щелочными растворами заключается в окислении металлической поверхности и образовании ионов металла в растворе. Щелочные компоненты, такие как гидроксиды, обладают сильной основностью и способны проникать в металлическую структуру, что приводит к окислению металла и его растворению.
